Альдегиды и кетоны — номенклатура, получение, химические свойства. Альдегиды и кетоны
Альдегиды и кетоны относятся к карбонильным органическим соединениям. Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула карбонильных соединений:
Функциональная группа –СН=О называется альдегидной. Кетоны - органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами. Общие формулы: R 2 C=O, R–CO–R" или
|
|
|
Модели простейших карбонильных соединений |
||
|
Название | ||
|
Формальдегид (метаналь) |
H 2 C=O | |
|
Ацетальдегид (этаналь) |
СH 3 -CH=O | |
|
Ацетон (пропанон) |
(СH 3 ) 2 C=O |
|
Номенклатура альдегидов и кетонов.
Систематические названия альдегидов строят по названию соответствующего углеводорода и добавлением суффикса -аль . Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении.
|
Формула |
Название |
|
|
систематическое |
тривиальное |
|
|
H 2 C=O |
метаналь |
муравьиный альдегид (формальдегид) |
|
CH 3 CH=O |
этаналь |
уксусный альдегид (ацетальдегид) |
|
(CH 3 ) 2 CHCH=O |
2-метил-пропаналь |
изомасляный альдегид |
|
CH 3 CH=CHCH=O |
бутен-2-аль |
кротоновый альдегид |
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон . Например: CH 3 –CO–CH 3 - диметилкетон (ацетон); CH 3 CH 2 CH 2 –CO–CH 3 - метилпропилкетон. В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он ; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура ИЮПАК). Примеры: CH 3 –CO–CH 3 - пропанон (ацетон); CH 3 CH 2 CH 2 –CO–CH 3 - пентанон- 2; CH 2 =CH–CH 2 –CO–CH 3 - пентен-4-он- 2.
Изомерия альдегидов и кетонов .
Для альдегидов и кетонов характерна структурная изомерия .
Изомерия альдегидов :
|
изомерия углеродного скелета, начиная с С 4 |
|
|
межклассовая изомерия с кетонами, начиная с С 3 |
|
|
циклическими оксидами (с С 2) |
|
|
непредельными спиртами и простыми эфирами (с С 3) |
|
|
Изомерия кетонов : углеродного скелета (c C 5) |
|
|
положения карбонильной группы (c C 5) |
|
межклассовая изомерия (аналогично альдегидам).
Строение карбонильной группы C=O.
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.

Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные -электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.

Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н + .
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С 2 –C 5 и кетоны С 3 –С 4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Реакционные центры альдегидов и кетонов
sp 2 -Гибридизованный атом углерода карбонильной группы образует три σ-связи, лежащие в одной плоскости, и π-связь с атомом кислорода за счет негибридизованной p-орбитали. Вследствие различия в электроотрицательности атомов углерода и кислорода π-связь между ними сильно поляризована (рис. 5.1). В результате на атоме углерода карбонильной группы возникает частичный положительный заряд δ+, а на атоме кислорода - частичный отрицательный заряд δ-. Поскольку атом углерода электронодефицитен, он представляет собой центр для нуклеофильной атаки.
Распределение электронной плотности в молекулах альдегидов и кетонов с учетом передачи электронного влияния электроно-

Рис. 5.1. Электронное строение карбонильной группы
дефицитного атома углерода карбонильной группы по σ-связям представлено на схеме 5.1.
Схема 5.1. Реакционные центры в молекуле альдегидов и кетонов

В молекулах альдегидов и кетонов присутствует несколько реакционных центров:
Электрофильный центр - атом углерода карбонильной группы - предопределяет возможность нуклеофильной атаки;
Основный центр - атом кислорода - обусловливает возможность атаки протоном;
СН-кислотный центр, атом водорода которого обладает слабой протонной подвижностью и может, в частности, подвергаться атаке сильным основанием.
В целом альдегиды и кетоны обладают высокой реакционной способностью.
Первая группа свойств реакции присоединения. В карбонильной группе между углеродом и кислородом присутствует двойная связь, которая, как вы помните, состоит из сигма-связи и пи-связи. В реакциях присоединения пи-связь рвется и образуются две сигма связи одна с углеродом, вторая с кислородом. На углероде сосредоточен частичный положительный заряд, на кислороде частичный отрицательный. Поэтому к углероду присоединяется отрицательно заряженная частица реагента, анион, а к кислород положительно заряженная часть молекулы.
Первое свойство гидрирование, присоединение водорода.
Реакция проходит при нагревании. Применяется уже известный вам катализатор гидрирования никель. Из альдегидов получаются первичные спирты, из кетонов вторичные.

У вторичных спиртов гидроксогруппа связана со вторичным атомом углерода.
Второе свойство гидратация, присоединение воды. Эта реакция возможна только для формальдегида и ацетальдегида. Кетоны совсем не реагируют с водой.
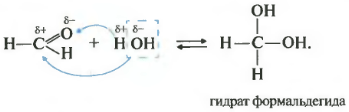
Все реакции присоединения идут таким образом, что плюс идет к минусу, а минус к плюсу.
Как вы помните из видео про спирты , наличие двух гидроксогрупп у одного атома почти невозможная ситуация, такие вещества крайне неустойчивы. Так вот конкретно два этих случая гидрат формальдегида и уксусного альдегида возможны, хотя и существуют только в растворе.
Сами реакции знать не обязательно. Скорее всего, вопрос на экзамене может звучать как констатация факта, допустим, с водой реагируют и перечислены вещества. Среди их перечня которых могут быть метаналь или этаналь.
Третье свойство присоединение синильной кислоты.

Снова плюс идет к минусу, а минус к плюсу. Получаются вещества, называемые гидроксинитрилами. Опять же, сама реакция встречается нечасто, но знать об этом свойстве нужно.
Четвертое свойство присоединение спиртов.
Здесь снова не нужно знать наизусть уравнение реакции, просто надо понимать, что такое взаимодействие возможно.

Как обычно в реакциях присоединения к карбонильной группе плюс к минусу, а минус к плюсу.
Пятое свойство реакция с гидросульфитом натрия.

И снова, реакция довольно сложная, выучить ее вряд ли получится, но это одна из качественных реакций на альдегиды, потому что полученная натриевая соль выпадает в осадок. То есть по факту вы должны знать, что альдегиды реагируют с гидросульфитом натрия, этого будет достаточно.
На этом закончим с первой группой реакций. Вторая группа реакции полимеризации и поликонденсации.
2. Полимеризация и поликонденсация альдегидов
С полимеризацией вы знакомы: полиэтилен, бутадиеновый и изопреновый каучуки, поливинилхлорид это продукты объединения множества молекул (мономеров) в одну большую, в единую полимерную цепь. То есть получается один продукт. При поликонденсации происходит то же самое, но помимо полимера получаются еще низкомолекулярные продукты, например, вода. То есть получается два продукта.
Итак, шестое свойство полимеризация. Кетоны в эти реакции не вступают, промышленное значение имеет только полимеризация формальдегида.
Пи-связь рвется и образуются две сигма связи с соседними мономерами. Получается полиформальдегид, называемый также параформ. Вероятнее всего, вопрос на экзамене может звучать так: в реакции полимеризации вступают вещества. И приведен список веществ, среди которых может быть в формальдегид.
Седьмое свойство поликонденсация. Еще раз: при поликонденсации помимо полимера получается еще низкомолекулярное соединение, например, вода. Формальдегид вступает в такую реакцию с фенолом. Для наглядности сначала запишем уравнение с двумя молекулами фенола.

В результате получается такой димер и отщепляется молекула воды. Теперь запишем уравнение реакции в общем виде.

Продуктом поликонденсации является феноло-формальдегидная смола. Она находит широкое применение от клеев и лаков до пластмасс и компонента древесно-стружечных плит.
Теперь третья группа свойств реакции окисления.
3. Окисление альдегидов и кетонов
Восьмой реакцией в общем списке является качественная реакция на альдегидную группу окисление аммиачным раствором оксида серебра. Реакция «серебряного зеркала». Скажу сразу, кетоны не вступают в эту реакцию, только альдегиды.

Альдегидная группа окисляется до карбоксильной, кислотной группы, но в присутствии аммиака, который является основание, сразу же происходит реакция нейтрализации и получается соль ацетат аммония. Серебро выпадает в осадок, покрывая пробирку изнутри и создавая зеркальную поверхность. Эта реакция встречается на ЕГЭ постоянно.
Кстати, эта же реакция является качественной на другие вещества, имеющие альдегидную группу, например, на муравьиную кислоту и ее соли, а также на глюкозу.
Девятая реакция тоже качественная на альдегидную группу окисление свежеосажденным гидроксидом меди два. Здесь тоже замечу, что кетоны не вступают в эту реакцию.

Визуально будет наблюдаться сначала образование желтого осадка, который потом становится красным. В некоторых учебниках встречается информация, что сначала образуется гидроксид меди один, имеющий желтый цвет, который затем распадается на красный оксид меди один и воду. Так вот это неверно по последним данным в процессе выпадения осадка меняется размер частиц оксида меди один, которые в конечном счете достигают размеров, окрашенных именно в красный цвет. Альдегид окисляется до соответствующей карбоновой кислоты. Реакция встречается на егэ очень часто.
Десятая реакция окисление альдегидов подкисленным раствором перманганата калия при нагревании.
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, то есть альдегид окисляется до соответствующей кислоты. Для кетонов эта реакция не имеет практического смысла, поскольку происходит разрушение молекулы и в результате получается смесь продуктов.
Важно отметить, что муравьиный альдегид, формальдегид, окисляется до углекислого газа, потому как соответствующая ему муравьиная кислота сама не устойчива к действию сильных окислителей.
В итоге углерод переходит из степени окисления 0 в степень окисления +4. Напомню, что и метанол, как правило, в таких условиях окисляется по максимуму до CO 2 , проскакивая стадию и альдегида, и кислоты. Эту особенность надо запомнить.
Одиннадцатая реакция горение, полное окисление. И альдегиды, и кетоны сгорают до углекислого газа и воды.
Запишем уравнение реакции в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле карбонильного соединения, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n воды, итого 3n. Слева атомов кислорода столько же 3n, но один из атомов находится в молекуле альдегида, значит его надо вычесть из общего количества, чтобы получить количество атомов, приходящихся на молекулярный кислород. Выходит 3n-1 атомов содержит молекулярный кислород, а значит молекул в 2 раза меньше, потому как в состав одной молекулы входят 2 атома. То есть (3n-1)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания карбонильных соединений в общем виде.
И, наконец, двенадцатое свойство, относящееся к реакциям замещения галогенирование по альфа-атому углерода. Еще раз обратимся к строению молекулы альдегида. Кислород оттягивает на себя электронную плотность, создавая частичный положительный заряд а углероде. Метильная группа пытается компенсировать этот положительный заряд, смещая к нему электроны от водорода по цепи сигма-связей. Связь углерод-водород становится более полярной и водород легче отрывается при атаке реагентом. Такой эффект наблюдается только для альфа-атома углерода, то есть атома следующего за альдегидной группой, вне зависимости от длины углеводородного радикала.
Таким образом, возможно получение, например, 2-хлорацетальдегида. Возможно дальнейшее замещение атомов водорода до трихлорэтаналя.
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3.
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
План
1. Методы получения.
2. Химические свойства.
2.1. Реакции нуклеофильного
присоединения.
2.2. Реакции по a -углеродному атому.
2.3. Реакции окисления и восстановления.
Альдегиды и кетоны содержат карбонильную группу
С=О. Общая формула:
1. Методы получения.

2. Химические
свойства.
Альдегиды и кетоны – один из наиболее реакционноспособных классов
органических соединений. Их химические свойства определяются присутствием
карбонильной группы. Вследствие большого различия в электроотрицательностях
углерода и кислорода и высокой поляризуемости p
-связи связь С=О обладает значительной полярностью
(m
С=О
=2,5-2,8 D). Атом углерода карбонильной
группы несет эффективный положительный заряд и является объектом для атаки
нуклеофилов. Основной тип реакций альдегидов и кетонов – реакции
нуклеофильного присоединения Ad
N . Кроме того, карбонильная группа оказывает влияние на
реакционную способность связи С-Н в
a
-положении, повышая ее кислотность.
Таким образом, молекулы альдегидов и кетонов
содержат два основных реакционных центра – связь С=О и связь С-Н в
a
-положении:

2.1. Реакции нуклеофильного
присоединения.
Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи.
Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем
образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и
дает продукт присоединения:

Активность карбонильных соединений в
Ad
N –реакциях зависит от величины
эффективного положительного заряда на карбонильном атоме углерода и объема
заместителей у карбонильной группы. Электронодонорные и объемистые заместители
затрудняют реакцию, электроноакцепторные заместители повышают реакционную
способность карбонильного соединения. Поэтому альдегиды в
Ad
N –реакциях активнее, чем
кетоны.
Активность карбонильных соединений повышается в
присутствии кислотных катализаторов, которые увеличивают положительный заряд на
карбонильном атоме углерода:

Альдегиды и кетоны присоединяют воду, спирты,
тиолы, синильную кислоту, гидросульфит натрия, соединения типа
NH
2 X. Все реакции присоединения
идут быстро, в мягких условиях, однако образующиеся продукты, как правило,
термодинамически не устойчивы. Поэтому реакции протекают обратимо, и содержание
продуктов присоединения в равновесной смеси может быть низким.
Присоединение воды.
Альдегиды и кетоны присоединяют воду с
образованием гидратов. Реакция протекает обратимо. Образующиеся гидраты
термодинамически не стабильны. Равновесие смещено в сторону продуктов
присоединения только в случае активных карбонильных соединений.

Продукт гидратации трихлоруксусного альдегида
хлоральгидрат – устойчивое кристаллическое соединение, которое используется в
медицине как успокаивающее и снотворное средство.
Присоединение спиртов и
тиолов.
Альдегиды присоединяют спирты с образованием полуацеталей
. При избытке спирта и в присутствии кислотного катализатора
реакция идет дальше – до образования ацеталей

Реакция образования полуацеталя протекает как
нуклеофильное присоединение и ускоряется в присутствии кислот или
оснований.

Процесс образования ацеталя идет как
нуклеофильное замещение ОН группы в полуацетале и возможен только в условиях
кислотного катализа, когда группа ОН превращается в хорошую уходящую группу
(H
2 O).

Образование ацеталей – обратимый процесс. В
кислой среде полуацетали и ацетали легко гидролизуются. В щелочной среде
гидролиз не идет. Реакции образования и гидролиза ацеталей играют важную роль в
химии углеводов.
Кетоны в аналогичных условиях кеталей не
дают.
Тиолы как более сильные нуклеофилы, чем спирты,
образуют продукты присоединения и с альдегидами, и с кетонами.
Присоединение синильной
кислоты
Синильная кислота присоединяется к карбонильным соединением в условиях
основного катализа с образованием циангидринов.

Реакция имеет препаративное значение и
используется в синтезе
a
-гидрокси- и
a
-аминокислот (см. лек. № 14). Плоды некоторых растений
(например, горький миндаль) содержат циангидрины. Выделяющаяся при их
расщеплении синильная кислота оказывает отравляющее действие
.
Присоединение бисульфита
натрия.
Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO 3 c образованием бисульфитных производных.

Бисульфитные производные карбонильных соединений
– кристаллические вещества, не растворимые в избытке раствора бисульфита натрия.
Реакция используется выделения карбонильных соединений из смесей. Карбонильное
соединение может быть легко регенерировано обработкой бисульфитного производного
кислотой
или щелочью.
Взаимодействие с соединениями общей
формулы NH
2 X.
Реакции протекают по общей схеме как процесс
присоединения-отщепления. Образующийся на первой стадии продукт присоединения не
устойчив и легко отщепляет воду.

По приведенной схеме с карбонильными
соединениями реагируют аммиак, первичные амины, гидразин, замещенные гидразины,
гидроксиламин.

Образующиеся производные представляют собой
кристаллические вещества, которые используют для выделения и идентификации
карбонильных соединений.
Имины (основания Шиффа) являются промежуточными
продуктами во многих ферментативных процессах (трансаминирование под действием
кофермента пиридоксальфосфата; восстановительное аминирование кетокислот при
участии кофермента НАД
Н). При каталитическом гидрировании иминов образуются
амины. Процесс используется для синтеза аминов из альдегидов и кетонов и
называется восстановительным аминированием.
Восстановительное аминирование протекает in vivo
в ходе синтеза аминокислот (см. лек. № 16)
2.2. Реакции по a -углеродному атому.
Кето-енольная таутомерия.
Водород в
a
-положении к карбонильной группе обладает кислотными
свойствами, так как образующийся при его отщеплении анион стабилизируется за
счет резонанса.

Результатом протонной подвижности атома водорода
в
a
-положении
является способность карбонильных соединений к образованию енольных форм за счет
миграции протона из
a
-положения к атому кислорода карбонильной группы.

Кетон и енол являются таутомерами
.
Таутомеры – это изомеры, способные быстро и обратимо превращаться друг в друга
за счет миграции какой-либо группы (в данном случае – протона). Равновесие между
кетоном и енолом называют кето-енольной таутомерией.
Процесс енолизации катализируется кислотами и
основаниями. Енолизация под действием основания может быть представлена
следующей схемой:
Большинство карбонильных соединений существуют
преимущественно в кетонной форме. Содержание енольной формы возрастает с
увеличением кислотности карбонильного соединения, а также в случае
дополнительной стабилизации енольной формы за счет водородной связи или за счет
сопряжения.
Таблица 8. Содержание енольных форм и
кислотность карбонильных соединений
Например, в 1,3-дикарбонильных соединениях
подвижность протонов метиленовой группы резко увеличивается за счет
электроноакцепторного влияния двух карбонильных групп. Кроме того, енольная
форма стабилизируется за счет наличия в ней системы сопряженных
p
-связей и внутримолекулярной
водородной связи.

Если соединение в енольной форме представляет
собой сопряженную систему с высокой энергией стабилизации, то енольная форма
преобладает. Например, фенол существует только в енольной форме.
Енолизация и образование енолят-анионов являются
первыми стадиями реакций карбонильных соединений, протекающих по
a
-углеродному атому. Важнейшими
из них являются галогенирование
и альдольно-кротоновая
конденсация
.
Галогенирование.
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl 2 ,
Br 2 , I 2 ) с образованием
исключительно
a
-галогенпроизводных.

Реакция катализируется кислотами или
основаниями. Скорость реакции не зависит от концентрации и природы галогена.
Процесс протекает через образование енольной формы (медленная стадия), которая
затем реагирует с галогеном (быстрая стадия). Таким образом, галоген не
участвует в скорость
—определяющей стадии
процесса.

Если карбонильное соединение содержит несколько
a
-водородных
атомов, то замещение каждого последующего происходит быстрее, чем предыдущего,
вследствие увеличения их кислотности под действием электроноакцепторного влияния
галогена. В щелочной среде ацетальдегид и метилкетоны дают
тригалогенпроизводные, которые затем расщеплятся под действием избытка щелочи с
образованием тригалогенметанов (галоформная реакция)
.
Расщепление трииодацетона протекает как реакция
нуклеофильного замещения. группы CI
3 — гидроксид-анионом, подобно S
N -реакциям в карбоксильной группе (см. лек. №12).
Иодоформ выпадает из реакционной смеси в виде
бледно-желтого кристаллического осадка с характерным запахом. Иодоформную
реакцию используют в аналитических целях для обнаружения соединений типа
СH
3 -CO-R, в том числе в
клинических лабораториях для диагностики сахарного диабета.
Реакции конденсации.
В присутствии каталитических количеств кислот
или щелочей карбонильные соединения, содержащие
a
-водородные атомы,
претерпевают конденсацию с образованием
b
-гидроксикарбонильных соединений.

В образовании связи С-С участвуют карбонильный
атом углерода одной молекулы (карбонильной компоненты
) и
a
-углеродный атом другой
молекулы (метиленовой компоненты
). Эта реакция носит название альдольной конденсации
(по названию продукта конденсации ацетальдегида –
альдоля).
При нагревании реакционной смеси продукт легко
дегидратируется с образованием
a
,b
-непредельного карбонильного
соединения.

Такой тип конденсации носит название кротоновой
(по названию продукта конденсации ацетальдегида – кротонового
альдегида).
Рассмотрим механизм альдольной конденсации в
щелочной среде. На первой стадии гидроксид-анион отрывает протон из
a
-положения карбонильного
соединения с образованием енолят-аниона. Затем енолят анион как нуклеофил
атакует карбонильный атом углерода другой молекулы карбонильного соединения.
Образующийся тетраэдрический интермедиат (алкоксид-анион) является сильным
основанием и отрывает далее протон от молекулы воды.

При альдольной конденсации двух различных
карбонильных соединений (перекрестная альдольная конденсация) возможно
образование 4-х разных продуктов. Однако этого можно избежать, если одно из
карбонильных соединений не содержит
a
-водородных атомов (например, ароматические альдегиды
или формальдегид) и не может выступать в качестве метиленовой компоненты.

В качестве метиленовой компоненты в реакциях
конденсации могут выступать не только карбонильные соединения, но и другие
С-Н-кислоты. Реакции конденсации имеют препаративное значение, так как позволяют
наращивать цепь углеродных атомов. По типу альдольной конденсации и
ретроальдольного распада (обратный процесс) протекают многие биохимические
процессы: гликолиз, синтез лимонной кислоты в цикле Кребса, синтез нейраминовой
кислоты.
2.3. Реакции окисления и
восстановления
Восстановление
Карбонильные соединения восстанавливаются до
спиртов в результате каталитического гидрирования или под действием
восстановителей, которые являются донорами гидрид-анионов.

[H]: H 2 /кат., кат. – Ni, Pt,
Pd;
LiAlH 4 ; NaBH 4 .
Восстановление карбонильных соединений
комплексными гидридами металлов включает нуклеофильную атаку карбонильной группы
гидрид-анионом. При последующем гидролизе образуется спирт.
Аналогично происходит восстановление
карбонильной группы in vivo под действием кофермента НАД
Н, который является
донором гидрид-иона (см. лек. №19).
Окисление
Альдегиды окисляются очень легко практически
любыми окислителями, даже такими слабыми, как кислород воздуха и соединения
серебра (I) и меди
(II).
Две последние реакции используются как
качественные на альдегидную группу.
В присутствии щелочей альдегиды, не содержащие
a
-водородных атомов
диспропорционируют с образованием спирта и кислоты (реакция Канницаро).
2HCHO + NaOH ® HCOONa + CH 3 OH
Это является причиной того, что водный раствор
формальдегида (формалин) при длительном хранении приобретает кислую
реакцию.
Кетоны устойчивы к действию окислителей в
нейтральной среде. В кислой и щелочной средах под действием сильных
окислителей
(KMnO 4 ) они
окисляются с разрывом связи С-С. Расщепление углеродного скелета происходит по
двойной углерод-углеродной связи енольных форм карбонильного соединения, подобно
окислению двойных связей в алкенах. При этом образуется смесь продуктов,
содержащая карбоновые кислоты или карбоновые кислоты и кетоны.





















 Назад
Вперёд
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель урока: характеризовать состав, строение, классификацию, физические и химические свойства, получение и применение альдегидов. Устанавливать взаимосвязь между изученными классами органических соединений. Знать качественные реакции на альдегиды.
Всюду в нашей жизни мы встречаемся с органической химией: мы едим продукты химической промышленности, мы одеваемся непосредственно в ее результаты: ацетатный шелк, искусственную шерсть, изделия из кожзаменителя и многое другое, благодаря химии мы можем проводить сложные операции (наркоз), лечить ангину и просто ставить уколы, где в качестве антисептика мы выбираем этиловый спирт.
Сегодня мы познакомимся с вами с классом органических веществ – альдегидами. Сегодня на уроке мы докажем, что жизнь без альдегидов невозможна. Узнаем, как связаны с этой темой хорошо известные вещества: ванилин, моющие средства, формалин, пластмасса, зеркало, уксусная кислота
Итак, альдегиды – это органические соединения, содержащие в составе своей молекулы, полярную карбонильную группу. В зависимости от заместителей, связанных с оксогруппой, эти вещества подразделяют на альдегиды и кетоны. В альдегидах с карбонильной группой связаны углеводородный радикал и атом водорода, тогда как в кетонах карбонильный углерод связан с двумя углеводородными радикалами.

Общая формула предельных карбонильных соединений C n H 2n O
Названия альдегидов по тривиальной номенклатуре часто производят от названий соответствующих монокарбоновых кислот. По рациональной номенклатуре альдегиды с разветвленной углеводородной цепью рассматриваются как производные ацетальдегида. По систематической номенклатуре названия рассматриваемых соединений производятся от соответствующих алканов с добавлением суффикса – аль.
Способы получения альдегидов. Основными способами получения альдегидов является каталитическое дегидрирование спиртов, гидратация алкинов, окисление спиртов.
Физические свойства.
Первый член гомологического ряда предельных альдегидов НСОН – бесцветный газ, несколько последующих альдегидов – жидкости. Высшие альдегиды – твердые вещества. Карбонильная группа обуславливает высокую реакционную способность альдегидов. Температура кипения альдегидов возрастает с увеличением молекулярной массы. Кипят они при более низкой температуре, чем соответствующие спирты, например пропионовый альдегид при 48,8 0 С, а пропиловый спирт – при 97,8 0 С.
Плотность альдегидов меньше единицы. Муравьиный и уксусный альдегиды хорошо растворяются в воде, последующие – хуже. Низшие альдегиды имеют резкий, неприятный запах, некоторые высшие – приятный запах.
Реакционная способность альдегидов обусловлена наличием активной карбонильной группы. Высокая электроотрицательность атома кислорода способствует сильной поляризации двойной связи в карбонильной группе и смещению подвижных?-электронов в сторону атома кислорода.

Химические свойства альдегидов:
1. Реакции присоединения:
А) реакция гидрирования
Б) реакция присоединения NaHSO 3
2. Реакции окисления:
А) реакция серебряного зеркала
Б) реакция светофор
3. Реакция поликонденсации
4. Реакция полимеризации
Качественная реакция на карбоксильную группу - реакция окисления альдегидов гидроксидом меди (ІІ) - светофор.
НСОН + 2Cu(OH) 2 = HCOOH +Cu 2 O +2H 2 O
“Реакция серебряного зеркала”
Вы можете представить себе жизнь без зеркала? Проснуться утром – и не увидеть своего отражения? Кажется, ерунда, мелочь. А ведь какой душевный дискомфорт! Недаром сказочных персонажей в качестве наказания лишали отражения. Что такое зеркало? В чем его сила? Откуда оно появилось? Как его изготавливают?
Как мы уже знаем, первыми настоящими зеркалами служили отполированные до блеска металлические пластинки из меди, золота, серебра. Однако такие зеркала имели большой недостаток – на воздухе быстро темнели и тускнели. Какой же выход нашли из этой ситуации? Многочисленные опыты показали, что блестящий металлический слой можно нанести и на стекло. Так, в I в. н.э. начали изготавливать стеклянные зеркала – стеклянные пластинки, соединенные со свинцовыми или оловянными пластинами. Делалось это так: мыли спиртом стекло, очищали его тальком и затем к поверхности плотно прижимали оловянный лист. Сверху наливали ртуть и, дав ей постоять, сливали избыток. Образовавшийся слой амальгамы заклеивали или закрашивали. Такие зеркала оказались намного долговечнее металлических, поэтому ремесленные мастерские перешли на выпуск стеклянных зеркал, отражающая поверхность которых была сделана из амальгамы олова (раствор олова Sn в ртути Hg). Но, поскольку пары ртути очень ядовиты, производство ртутных зеркал было весьма вредным, да и сами зеркала содержали ртуть. Было опасно держать ртутные зеркала в жилых помещениях.
Поэтому ученые продолжали искать замену для ртути. Ее нашли французский химик Франсуа Птижан и великий немецкий ученый Юстус Либих. Либих предложил изготавливать стеклянные зеркала с серебряным покрытием. Разработанный им метод состоял из следующих операций. Сначала к водному раствору нитрата серебра AgNO 3 добавляли водный раствор гидроксида калия KОН, что приводило к осаждению черно-коричневого осадка оксида серебра Ag 2 O.
2AgNO 3 + 2KOH = Ag 2 O + 2KNO 3 + H 2 O.
Осадок отфильтровывали и перемешивали с водным раствором аммиака NH 3 .
Ag 2 O + 4NH 3 + H 2 O = 2 (OH).)
Оксид серебра растворялся в аммиачной воде с образованием комплексного соединения (аммиаката, или аммина) – гидроксида диамминсеребра(I). Затем в полученный прозрачный раствор погружали лист стекла, одна из поверхностей которого была тщательно обезжирена, и добавляли формальдегид НСНО.
2(OH) + HCHO = 2Ag + HCOONH 4 + 3NH 3 + H 2 O.)
Формальдегид восстанавливал серебро, которое осаждалось на очищенной поверхности стекла, покрывая его блестящим зеркальным налетом.
Применение альдегидов и кетонов.
Формальдегид. Первым членом гомологического ряда предельных альдегидов является формальдегид НСОН. Его называю также метаналь и муравьиный альдегид. Он представляет собой бесцветный газ с характерным резким запахом. Широко применяется водный раствор, содержащий в массовых долях 0,4, или 40%, метаналя. Он называется формалином. Формальдегид (формалин), прозрачная бесцветная жидкость со своеобразным острым запахом. Применяют как дезинфицирующее и дезодорирующее средство для мытья рук, обмывания кожи при повышенной потливости (0,5–1%), для дезинфекции инструментов (0,5%), для спринцеваний (1:2000 – 1:3000). Входит в состав лизоформа.
Его использование основано также на свойстве свертывать белок. Так, например, в кожевенном производстве дубящее действие формалина объясняется свертыванием белка, в результате чего кожа твердеет и не подвергается гниению. На этом же свойстве основано применение формалина для сохранения биологических препаратов. Иногда формалин используется для дезинфекции и протравливания семян. Метаналь идет на производство некоторых лекарственных веществ и красителей. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс.

Пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирте получают различные лаки.
При взаимодействии метаналя с карбамидом СО(NН) 2 получают карбамидную смолу, а из нее – аминопласты. Из этих пластмасс изготовляют микропористые материалы для нужд электротехники (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор. Тепло – и звукоизоляционные пористые материалы.
Ацетальдегид СН 3 – СОН представляет собой бесцветную жидкость с резким удушающим запахом. Применяют в производстве ацетатов целлюлозы, уксусной и пероксиуксусной кислот, уксусного ангидрида, этилацетата, глиоксаля, алкиламинов, бутанола, хлораля. Подобно формальдегиду он вступает в реакции поликонденсации с аминами, фенолом и другими веществами, образуя синтетические смолы, широко применяемые в промышленности.
Бензальдегид С 6 Н 5 С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях.
Алифатический альдегид СН 3 (СН 2) 7 С (Н)=О (тривиальное название – пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ароматический альдегид ванилин содержится в плодах тропического растения ванили, сейчас чаще используется синтетический ванилин – широко известная ароматизирующая добавка в кондитерские изделия.
Цитраль С 10 Н 15 О (3,7-диметил – 2,6-октадиеналь) с запахом лимона используется в средствах бытовой химии.
Кротоновый альдегид. Сильный лакриматор, используют для получения бутанола, сорбиновой и масляной кислот. Содержится в соевом масле. Применение альдегидов в медицине.
Коричный альдегид содержится в масле корицы, его получают перегонкой коры дерева корицы. Применяется в кулинарии в виде палочек или порошка
Уротропин (CH 2) 6 N 4 (гексаметилентетрамин), бесцветные кристаллы без запаха, легко растворимы в воде. Водные растворы имеют щелочную реакцию. Обладает антисептическим действием. Применяют главным образом при инфекционных процессах мочевыводящих путей (циститах, пиелитах). Действие основано на способности препарата разлагаться в кислой среде с образованием формальдегида. Назначают препарат натощак. Показаниями для его применения служат холециститы, холангиты, аллергические заболевания кожи, глаз (кератиты, иридоциклиты и др.). Препарат может вызвать раздражение паренхимы почек, при этих признаках прием препарата прекращают.
Акролеин. Используется для производства пластмасс, отличающихся большой твердостью. Акролеин и его натриевые соли являются эмульгаторами, структурирующими почвы, лактонные его производные улучшают свойства бумаги и текстильных изделий.
Обобщение и систематизация знаний. Подведение итогов урока.
Таким образом, способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
Домашнее задание.








 Чудотворения по молитвам преподобного игумена мефодия пешношского чудотворца
Чудотворения по молитвам преподобного игумена мефодия пешношского чудотворца Как приготовить салат из свежих кабачков: рецепты с фото Салат из кабачков овощечисткой
Как приготовить салат из свежих кабачков: рецепты с фото Салат из кабачков овощечисткой Рецепт: Песочное печенье из ржаной муки - в духовке Печенье из ржаной муки
Рецепт: Песочное печенье из ржаной муки - в духовке Печенье из ржаной муки Здание известие. Известия
Здание известие. Известия Космическая Лайка: собака, растрогавшая весь мир Число рождения для мужчины
Космическая Лайка: собака, растрогавшая весь мир Число рождения для мужчины Рецепт: Кекс на сливках - с белковой глазурью Простой рецепт кекса с обилием сухофруктов
Рецепт: Кекс на сливках - с белковой глазурью Простой рецепт кекса с обилием сухофруктов Мужские имена и их значение
Мужские имена и их значение