Závislosť rýchlosti enzymatických reakcií od koncentrácie substrátov, enzýmov a teploty. Rýchlosť reakcie enzýmu
KURZOVÁ PRÁCA
Kinetika enzymatických reakcií
Úvod
Základom životnej činnosti každého organizmu sú chemické procesy. Takmer všetky reakcie v živom organizme prebiehajú za účasti prirodzených biokatalyzátorov – enzýmov.
Berzelius v roku 1835 ako prvý navrhol, že reakcie živého organizmu sa uskutočňujú vďaka novej sile, ktorú nazval „katalytická“. Túto myšlienku založil najmä na experimentálnom pozorovaní, že diastáza zo zemiakov hydrolyzuje škrob rýchlejšie ako kyselina sírová. Už v roku 1878 nazval Kuhne látku, ktorá má v živom organizme katalytickú silu, enzýmom.
Kinetika pôsobenia enzýmov je odvetvie enzymológie, ktoré študuje závislosť rýchlosti reakcie katalyzovanej enzýmami od chemickej povahy a podmienok interakcie substrátu s enzýmom, ako aj od faktorov prostredia. Inými slovami, kinetika enzýmov nám umožňuje pochopiť povahu molekulárnych mechanizmov pôsobenia faktorov ovplyvňujúcich rýchlosť enzymatickej katalýzy. Táto sekcia vznikla na priesečníku takých vied ako biochémia, fyzika a matematika. Prvý pokus o matematický opis enzymatických reakcií urobil Duclos v roku 1898.
V skutočnosti je táto časť o štúdiu enzýmov veľmi dôležitá v našej dobe, a to pre praktickú medicínu. Farmakológom dáva nástroj na cielené zmeny bunkového metabolizmu, obrovské množstvo liečiv a rôznych jedov – ide o inhibítory enzýmov.
Účelom tejto práce je zvážiť závislosť rýchlosti reakcie od rôznych faktorov, ako možno rýchlosť reakcie riadiť a ako ju možno určiť.
1. Michaelis-Menten kinetika
Predbežné experimenty študujúce kinetiku enzymatických reakcií ukázali, že rýchlosť reakcie, na rozdiel od teoretických očakávaní, nezávisí od koncentrácie enzýmu (E) a substrátu (S) rovnakým spôsobom ako v prípade konvenčného sekundárneho reakcia na objednávku.
Brown a nezávisle od neho Henri najprv predpokladali vznik komplexu enzým-substrát počas reakcie. Tento predpoklad bol potom potvrdený tromi experimentálnymi faktami:
a) papaín tvoril nerozpustnú zlúčeninu s fibrínom (Wurtz, 1880);
b) invertázový substrát sacharóza by mohol chrániť enzým pred tepelnou denaturáciou (O" Sullivan a Thompson, 1890);
c) ukázalo sa, že enzýmy sú stereochemicky špecifické katalyzátory (Fisher, 1898-1899).
![]()
Predstavili koncept maximálnej rýchlosti a ukázali to saturačná krivka(t.j. závislosť rýchlosti reakcie od koncentrácie substrátu) je rovnostranná hyperbola. Dokázali, že maximálna pozorovaná rýchlosť je jednou z asymptot krivky a segment odrezaný na osi x (v oblasti jej záporných hodnôt) druhou asymptotou, t.j. konštantná v rovnici rýchlosti, ktorá sa v absolútnej hodnote rovná koncentrácii substrátu potrebnej na dosiahnutie polovice maximálnej rýchlosti.
Michaelis a Menten navrhli, že rýchlosť reakcie je určená rozpadom komplexu ES, t.j. konštanta k 2 . To je možné len vtedy, ak k 2 - najmenšia z rýchlostných konštánt. V tomto prípade sa rovnováha medzi komplexom enzým-substrát, voľným enzýmom a substrátom nastaví rýchlo v porovnaní s rýchlosťou reakcie (rýchlo nastolená rovnováha).
Počiatočnú rýchlosť reakcie možno vyjadriť nasledujúcim vzorcom:
v = k 2
Pretože disociačná konštanta komplexu enzým-substrát je rovná
Ks = [E] [S]/= k-1/k1
potom môže byť koncentrácia voľného enzýmu vyjadrená ako
[E] = K S / [S]
Celková koncentrácia enzýmu v reakčnej zmesi je určená vzorcom
[E] t = [E] + [ES] = KS [ES] / [S] + [ES]
Reakcia dosiahne maximálnu rýchlosť, keď je koncentrácia substrátu dostatočne vysoká na to, aby boli všetky molekuly enzýmu prítomné vo forme komplexu ES (nekonečne veľký prebytok substrátu). Pomer počiatočnej rýchlosti k teoreticky možnej maximálnej rýchlosti sa rovná pomeru [ES] k [E] t:
v / V max = / [E] t = / (K S / [S] + ) = 1 / (K S + [S] +1)

Toto je klasická rovnica Michaelis A Menten, ktorý sa od svojho zverejnenia v roku 1913 stal na desaťročia základným princípom všetkých štúdií kinetiky enzýmov a s určitými obmedzeniami ním zostáva dodnes.
Neskôr sa ukázalo, že pôvodná Michaelis-Mentenova rovnica mala niekoľko obmedzení. Je spravodlivé, t.j. správne opisuje kinetiku reakcie katalyzovanej daným enzýmom iba vtedy, ak sú splnené všetky nasledujúce obmedzujúce podmienky:
) vzniká kineticky stabilný komplex enzým-substrát;
) konštanta K S je disociačná konštanta komplexu enzým-substrát: to platí len vtedy, ak ;
) koncentrácia substrátu sa počas reakcie nemení, t.j. koncentrácia voľného substrátu sa rovná jeho počiatočnej koncentrácii;
) reakčný produkt sa rýchlo odštiepi od enzýmu, t.j. nevytvára sa žiadne kineticky významné množstvo ES komplexu;
) druhý stupeň reakcie je nevratný; presnejšie, berieme do úvahy len počiatočnú rýchlosť, kedy možno spätnú reakciu (v dôsledku skutočnej absencie produktu) ešte zanedbať;
) iba jedna molekula substrátu sa viaže na každé aktívne miesto enzýmu;
) pre všetky reagujúce látky možno namiesto aktivít použiť ich koncentrácie.
Michaelis-Mentenova rovnica slúži ako východiskový bod pre akýkoľvek kvantitatívny popis pôsobenia enzýmu. Malo by sa zdôrazniť, že kinetické správanie väčšiny enzýmov je oveľa zložitejšie ako to, ktoré vyplýva z idealizovanej schémy, ktorá je základom Michaelis-Mentenovej rovnice. Odvodenie tejto rovnice predpokladá, že existuje len jeden komplex enzým-substrát. Medzitým sa v skutočnosti pri väčšine enzymatických reakcií vytvoria aspoň dva alebo tri takéto komplexy vyskytujúce sa v určitom poradí.
Tu EZ označuje komplex zodpovedajúci skutočnému prechodnému stavu a EP označuje komplex medzi enzýmom a reakčným produktom. Možno tiež poukázať na to, že vo väčšine enzymatických reakcií sa zúčastňuje viac ako jeden substrát, a preto sa tvoria dva alebo viac produktov. Pri reakcii s dvoma substrátmi S1 a S2 môžu vzniknúť tri komplexy enzým-substrát, a to ES 1, ES 2 a ES 1 S 2. Ak reakcia produkuje dva produkty, P1 a P2, potom môžu existovať aspoň tri ďalšie komplexy EP1, EP2 a EP1P2. Pri takýchto reakciách existuje mnoho medzistupňov, z ktorých každý je charakterizovaný vlastnou rýchlostnou konštantou. Kinetická analýza enzymatických reakcií zahŕňajúcich dva alebo viac reaktantov je často mimoriadne zložitá a vyžaduje použitie elektronických počítačov. Pri analýze kinetiky všetkých enzymatických reakcií je však východiskovým bodom vždy vyššie uvedená Michaelis-Mentenova rovnica.
1.1 Povaha konštantyKv rovnici
rovnica kinetika enzymatickej reakcie
Druhý postulát uvádza, že konštanta K S v rovnici je disociačná konštanta komplexu enzým-substrát.
Briggs a Haldane v roku 1925 dokázali, že pôvodná Michaelis-Mentenova rovnica platí len pre , t.j. keď sa rovnováha elementárneho stupňa E+S ES ustanoví veľmi rýchlo v porovnaní s rýchlosťou nasledujúceho stupňa. Preto sa hovorí, že takéto kinetické mechanizmy (podliehajúce počiatočnej Michaelis-Mentenovej podmienke a majúce jeden pomalý elementárny stupeň, v porovnaní s ktorým sa rýchlo ustanovia rovnováhy vo všetkých ostatných elementárnych etapách) spĺňajú predpoklad „rýchlej rovnováhy“. Ak je však k 2 rádovo porovnateľné s k -1 ,
Zmenu koncentrácie komplexu enzým-substrát v priebehu času možno vyjadriť nasledujúcou diferenciálnou rovnicou:
d/dt = k1[E][S]-k-1-k2
Keďže uvažujeme počiatočnú rýchlosť reakcie, t.j. v momente, keď ešte nenastala reverzná reakcia a predstacionárne štádium už prešlo, potom sa v dôsledku prebytku substrátu množstvo vytvoreného komplexu enzým-substrát rovná množstvu dezintegrovaného ( stacionárny princíp alebo Briggsova a Haldaneova kinetika alebo Bodensteinov princíp v chemickej kinetike) a platí, že
d/dt = 0
Dosadením do diferenciálnej rovnice dostaneme výraz pre koncentráciu voľného enzýmu:
[E] = (k -1 + k 2) / k 1 [S]
[E] T = [E] + = [(k -1 + k 2) / k -1 [S] + 1] =
= (k-1 + k2 + k-1 [S]) / k1 [S]
Rovnica ustáleného stavu:
K 1 [S] [E] T / (k -1 + k 2 + k 1 [S])
Pretože v = k 2 , potom dostaneme, že
v = k1k2 [S] [E] T / (k-1 + k2 + k1 [S]) = k2 [S] [E] T / [(k-1 + k2) / k 1 + [S]]
V tomto prípade
V max = k 2 [E] T
a rovná sa maximálnej rýchlosti získanej z Michaelis-Mentenovej rovnice. Konštanta v menovateli Michaelisovej-Mentenovej rovnice však nie je K S ,
tie. nie disociačná konštanta komplexu enzým-substrát, ale tzv Michaelisova konštanta:
Km = (k-1 + k2)/k1
Km sa rovná Ks iba vtedy, ak .
V prípade konštanty v menovateli je rovnica rýchlosti vyjadrená vzorcom
Kk = k2/k1
a volá sa podľa Van Slykea, kinetická konštanta.
Rovnicu ustáleného stavu možno získať aj z diferenciálnej rovnice bez predpokladu, že d / dt = 0. Ak do diferenciálnej rovnice dosadíme hodnotu [E] = [E] T -, po transformáciách dostaneme
= (k 1 [S] [E] T - d / dt) / (k 1 [S] + k -1 + k 2)
Na získanie stacionárnej rovnice z tejto rovnice nie je potrebné, aby d / dt = 0. Stačí, aby bola splnená nerovnosť d / dt<< k 1 [S] [E] T . Этим объясняется, почему можно достичь хорошего приближения в течение длительного времени при использовании принципа стационарности.
Diferencovaná rovnica ustáleného stavu je nasledovná:
d / dt = T / (k1 [S] + k -1 + k 2) 2] (d [S] / dt)
Tento výraz sa zjavne nerovná 0.
1.2 Transformácia Michaelis-Mentenovej rovnice
Pôvodná Michaelis-Mentenova rovnica je rovnica hyperboly, kde jedna z konštánt (V max) je asymptota krivky. Ďalšia konštanta (K m), ktorej záporná hodnota je určená druhou asymptotou, sa rovná koncentrácii substrátu potrebnej na dosiahnutie V max / 2. Dá sa to ľahko overiť, pretože ak
v = V max / 2, potom
V max / 2 = V max [S] / (K m + [S])
Vmax / Vmax = 1 = 2 [S] / (Km + [S]) m + [S] = 2 [S], t.j. [S] = Km pri v = Vmax/2.
Michaelis-Mentenovu rovnicu možno algebraicky transformovať do iných foriem, ktoré sú vhodnejšie na grafické znázornenie experimentálnych údajov. Jedna z najbežnejších transformácií jednoducho spočíva v porovnávaní prevrátených hodnôt ľavej a pravej strany rovnice.


Výsledkom transformácie získame výraz

ktorá sa volá Lineweaver-Burk rovnice. Podľa tejto rovnice je graf vynesený v súradniciach 1/[S] a 1/v priamkou, ktorej sklon sa rovná K m /V max a segment odrezaný na osi y sa rovná 1. /V max. Takýto graf zostrojený metódou dvojitej reciprocity má tú výhodu, že umožňuje presnejšie určiť V max ; na krivke vynesenej v súradniciach [S] a v je V max asymptotická hodnota a je určená oveľa menej presne. Segment odrezaný na osi x na Lineweaver-Burkovom grafe sa rovná -1/K m. Z tohto grafu možno tiež získať cenné informácie týkajúce sa inhibície enzýmov.
Ďalšou transformáciou Michaelisovej-Mentenovej rovnice je, že obe strany Lineweaverovej-Burkovej rovnice sa vynásobia V max *v a po niekoľkých dodatočných transformáciách dostaneme

Príslušný graf v súradniciach v a v/[S] predstavuje s e 4, obr. 1]. Takýto rozvrh ( Graf Edie-Hofstee) umožňuje nielen veľmi jednoducho určiť hodnoty V max a K m , ale tiež umožňuje identifikovať možné odchýlky od linearity, ktoré nie sú detekované na Lineweaver-Burk grafe.
Rovnicu možno linearizovať aj v inej forme
[S]/v = Km/Vmax + [S]/Vmax
V tomto prípade by sa mala vykresliť závislosť [S] / v od [S]. Sklon výslednej priamky je 1/V max; segmenty odrezané na osi y a x sú rovné (K m / V max) a (- K m). Tento graf sa volá podľa mena autora. Haynesov graf.
Štatistická analýza ukázala, že metódy Edie-Hofstee a Haynes poskytujú presnejšie výsledky ako metóda Lineweaver-Burk. Dôvodom je to, že v grafoch Edie-Hofstee a Haynes sú závislé aj nezávislé premenné zahrnuté v množstvách vynesených na oboch súradnicových osiach.
1.3 Vplyv koncentrácie substrátu na kinetiku reakcie
V mnohých prípadoch nie je splnená podmienka konštantnej koncentrácie substrátu. Na jednej strane sa nadbytok substrátu nepoužíva pri in vitro reakciách s niektorými enzýmami kvôli často sa vyskytujúcej inhibícii enzymatickej aktivity substrátu. V tomto prípade je možné použiť iba jeho optimálnu koncentráciu, čo nie vždy poskytuje nadbytočný substrát potrebný na splnenie kinetických rovníc mechanizmov diskutovaných vyššie. Navyše v bunke in vivo sa zvyčajne nedosiahne nadbytok substrátu potrebný na dosiahnutie tohto stavu.
Pri enzymatických reakciách, kde substrátu nie je nadbytok, a preto sa jeho koncentrácia počas reakcie mení, je disociačná konštanta komplexu enzým-substrát rovná
K S = ([S] 0 - - [P]) [E] T - )/
([S]o - koncentrácia substrátu v t = 0). V tomto prípade je počiatočná rýchlosť reakcie (v ustálenom stave) určená vzorcom
v= V max / (Km + )
kde je koncentrácia substrátu v čase.
Je však možné napísať približné riešenie pre dva prípady, keď [S] o = :
) ak táto nerovnosť platí v dôsledku veľkých hodnôt t, t.j. keď sa počas reakcie spotrebuje viac ako 5 % počiatočnej koncentrácie substrátu;
) ak nemožno zanedbať koncentráciu enzýmu v porovnaní s koncentráciou substrátu a teda treba brať do úvahy koncentráciu komplexu enzým-substrát.
Ak je t veľké a koncentrácia je zanedbateľná v porovnaní s [S]0, potom rovnica pre disociačnú konštantu komplexu enzým-substrát bude nasledujúca:
K S = ([S] 0 - [P]) ([E] T - ) /
Pre hodnotu koncentrácie, ktorá sa mení počas reakcie, je uspokojivá aproximácia hodnota ([S] 0 + )/2. Pretože = [S] 0 - [P], priemerná rýchlosť; možno vyjadriť ako
![]()
Nahradením tohto výrazu a približnej hodnoty do
v= V max / (Km+),
dostaneme:
Pri porovnaní hodnôt vypočítaných z tejto aproximácie s hodnotami získanými z presnej integrovanej Michaelisovej-Mentenovej rovnice sa ukazuje, že chyba v určení K m je 1 a 4 % pri spotrebe 30 a 50 % substrátu. V dôsledku toho je chyba v tejto aproximácii zanedbateľná v porovnaní s chybou merania.
Keď spotreba substrátu nepresiahne 5 % počiatočnej koncentrácie, ale koncentrácia enzýmu je taká vysoká, že v porovnaní s [S] 0 ju nemožno ignorovať, je disociačná konštanta komplexu enzým-substrát rovná:
Ks = ([S] 0 - ) ([E] T - ) /
Jeho riešenie relatívne dáva
Z dvoch možných riešení je možné zvoliť iba záporné, pretože iba to spĺňa počiatočné podmienky: = 0 s [S] 0 = 0 alebo [E] T = 0. Analogicky s rovnicou pre pomer v/V max, dostali sme rovnicu pre počiatočnú rýchlosť. Kvadratická rovnica získaná z rovnice disociačnej konštanty komplexu enzým-substrát, ktorá sa nachádza vyššie, pomocou vzorcov v = k 2 a V max = k 2 [E] T, sa môže zredukovať do nasledujúceho tvaru:
[S] 0 V max / v = K s V max / (V max - v) + [E] T
Je potrebné zvážiť dva obmedzujúce prípady. V prvom prípade [S]<
v = (V max / K m) [S] = k[S]
Takto sme získali zjavnú reakciu prvého poriadku a k=Vmax/Km - zjavnú kinetickú konštantu prvého poriadku. Jeho skutočný rozmer je čas -1, ale ide o kombináciu rýchlostných konštánt prvého a druhého rádu niekoľkých elementárnych stupňov, t.j. k 1 k 2 [E] T / (k -1 + k 2) . Za zdanlivých podmienok prvého rádu k je mierou priebehu reakcie.
Ďalší extrémny prípad: [S] >>
Km.
Tu konštanta K m
je zanedbateľná v porovnaní s [S], a tak dostaneme v = V max.
1.4 Tvorba kineticky stabilného komplexu enzým-produkt
Ak sa počas reakcie vytvorí kineticky stabilný komplex enzým-produkt, mechanizmus reakcie je nasledujúci:
Pomocou predpokladu ustáleného stavu môžeme napísať diferenciálne rovnice:
d/dt = k 1 [E] [S] + k -2 - (k -1 + k 2) = 0 /dt = k 2 - (k -2 + k 3) = 0
Z týchto rovníc to vyplýva
= [(k -2 + k 3) / k 2]
[E] = [(k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 k 2 [S]]
Pretože v = k 3
a [E] T = [E] + + =
= [(k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 k 2 [S] + (k -2 + k 3) / k 2 + 1] =
= ( (k -2 + k 3) + k 1 k 2 [S]] / k 1 k 2 [S])
dostaneme
K 1 k 2 [S] [E] T / (k -2 + k 3 + k 2)] = k 1 k 2 k 3 [S] [E] T / (k -2 + k 3 + k 2) ] =
= [E] T [S] / [(k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 (k -2 + k 3 + k 2) + [S]]
Teda
V max = [E] Tm = (k -1 k -2 + k -1 k -3 + k 2 k 3) / k 1 (k -2 + k 3 + k 2)
V tomto prípade je už veľmi ťažké vypočítať konkrétne hodnoty jednotlivých rýchlostných konštánt, pretože priamo merať možno iba ich pomer. Situácia sa ešte viac skomplikuje, keď sa mechanizmus enzymatickej reakcie stane zložitejším, keď sa reakcie zúčastnia viac ako dva komplexy, pretože počet rýchlostných konštánt v rovnici je prirodzene oveľa väčší a ich vzťahy sú tiež zložitejšie.
Situácia sa však zjednoduší, ak po reverzibilnej reakcii tvorby prvého komplexu sú nasledujúce elementárne stupne nevratné. Významnými predstaviteľmi enzýmov, ktoré sa riadia týmto mechanizmom, sú proteolytické enzýmy a esterázy. Mechanizmus ich reakcie možno napísať takto:
kde ES' je acylenzýmový medziprodukt, ktorý sa pri vystavení vode rozkladá. Môžeme si písať
V max = k 2 k 3 [E] 0 / (k 2 + k 3) = k kat [E] 0m = k 3 (k -1 + k 2) / (k 2 + k 3) k 1 kat / K m = k2k1/(k-1 + k2) = k2/Km'
Michaelisova konštanta acylačného štádia je Km"Ks. Čím vyšší je pomer kcat/Km, tým vyššia je špecifickosť substrátu.
Stanovenie konštánt je značne zjednodušené, ak sa experiment uskutočňuje v prítomnosti nukleofilného činidla (N), ktoré môže konkurovať vode. Potom

k3 = k3' a Pi (i = 1, 2, 3) sú produkty.
v i = k kat, i [S] / (K m + [S]) kat, 1 = k 2 (k 3 + k 4 [N]) / (k 2 + k 3 + k 4 [N]) kat, 2 = k 2 k 3 / (k 2 + k 3 + k 4 [N]) kat, 3 = k 2 k 4 [N] / (k 2 + k 3 + k 4 [N]) m = K s ( k 3 + k 4 [N]) / (k 2 + k 3 + k 4 [N])
/v N = Ks (k3 + k4 [N]) / k2 k3 [S] + (k2 + k3 + k4 [N]) / k2 k3
Pretože je známe, že K s / k 2 = K m / k cat, a ak neexistuje žiadny nukleofil, potom
1/v = Ks / k 2 [S] + (k 2 + k 3) / k 2 k 3
a na určenie konštánt môžete použiť priesečník čiar v súradniciach 1/v N (a 1/v) - 1/[S]. Dve priamky v dvojitých inverzných súradniciach sa pretínajú v druhom kvadrante. V neprítomnosti nukleofilu je priesečník priamky s vertikálnou osou definovaný ako 1/V max a 1/k cat a s horizontálnou osou -1/K m. Súradnice priesečníka dvoch priamok: -1/K s a 1/k 3. Vzdialenosť medzi 1/V max a 1/k3 je 1/k2.
1.5 Analýza úplnej reakčnej kinetickej krivky
Michaelis-Mentenova rovnica v pôvodnej podobe platí len pre nevratné reakcie, t.j. na reakcie, kde sa berie do úvahy len počiatočná rýchlosť a reverzná reakcia sa nevyskytuje v dôsledku nedostatočného množstva produktu a neovplyvňuje rýchlosť reakcie. V prípade ireverzibilnej reakcie je možné jednoducho analyzovať kompletnú kinetickú krivku (pre ľubovoľný časový interval t ),
integrovaním pôvodnej Michaelis-Mentenovej rovnice. V tomto prípade teda zostáva predpoklad, že pri reakcii vzniká len jeden medziprodukt komplex enzým-substrát. Keďže pre časový interval t
nie sú stanovené žiadne obmedzenia, koncentrácia substrátu v čase analýzy sa nemôže rovnať jeho počiatočnej koncentrácii. Treba teda brať do úvahy aj zmenu [S] počas reakcie. Nech S 0 je počiatočná koncentrácia substrátu, (S 0 - y )
- koncentrácia v čase t .
Potom na základe pôvodnej rovnice Michaelis - Menten (ak y
- množstvo premeneného substrátu), môžeme písať
dy / dt = V max (S 0 - y) / (K m + S 0 - y)
Ak vezmeme recipročné hodnoty a rozdelíme premenné, integrujeme cez y
v rozmedzí od 0 do y
(V max je označené ako V):
(2,303 / t) log = V / K m - (1 / K m) (y / t)
Po vynesení závislosti ľavej strany rovnice na y/t (Foster-Niemannove súradnice) ,
dostaneme priamku so sklonom (-1/K m) ,
odrezanie segmentu na zvislej osi (V/K m) ,
a na osi x je segment V. Integrálna rovnica môže byť linearizovaná aj iným spôsobom:
t / 2,3031 lg = y / 2,303 V lg + K m / V
alebo t/y = 2,3031 Km/g/Vy+1/V
Ak študujeme reverzibilnú reakciu, musíme venovať pozornosť tomu, s akým časovým intervalom sa zaoberáme. V momente zmiešania enzýmu so substrátom nastáva takzvaná predstacionárna fáza trvajúca niekoľko mikro- alebo milisekúnd, počas ktorej vznikajú komplexy enzým-substrát zodpovedajúce stacionárnemu stavu. Pri štúdiu reverzibilných reakcií počas pomerne dlhých časových období táto fáza nehrá významnú úlohu, pretože v tejto fáze reakcia neprebieha plnou rýchlosťou v žiadnom smere.
Pre reakciu prebiehajúcu zľava doprava dosahujú komplexy enzým-substrát zúčastňujúce sa reakcie rýchlosť obmedzujúcu koncentráciu až na konci predstacionárnej fázy. Kvázistacionárny stav, v ktorom sa koncentrácie komplexov enzým-substrát určujúce rýchlosť blížia k maximálnym hodnotám koncentrácie v ustálenom stave, trvá niekoľko desatín sekundy alebo sekundy. Počas tejto fázy je rýchlosť tvorby produktu (alebo spotreba substrátu) v čase takmer lineárna. Teoreticky k tvorbe produktu ešte nedošlo, ale v praxi je jeho koncentrácia taká nízka, že rýchlosť spätnej reakcie neovplyvňuje rýchlosť priamej reakcie. Táto lineárna fáza sa nazýva počiatočná reakčná rýchlosť a doteraz sme ju len brali do úvahy.
Reakcia sprava doľava sa v ďalšej fáze zrýchľuje aj vďaka postupnému zvyšovaniu koncentrácie produktu (prechodný stav; mizne doteraz pozorovaná linearita v čase). Táto fáza pokračuje, kým sa rýchlosť reakcie zľava doprava nerovná rýchlosti reakcie sprava doľava. Toto je štát dynamická rovnováha, pretože reakcia pokračuje nepretržite v oboch smeroch rovnakou rýchlosťou.
2. Faktory, od ktorých závisí rýchlosť enzymatickej reakcie
.1 Závislosť rýchlosti enzymatickej reakcie od teploty
Keď sa teplota prostredia zvyšuje, rýchlosť enzymatickej reakcie sa zvyšuje, dosahuje maximum pri nejakej optimálnej teplote a potom klesá na nulu. Pre chemické reakcie platí pravidlo, že pri zvýšení teploty o 10°C sa rýchlosť reakcie zvýši dvakrát až trikrát. Pre enzymatické reakcie je tento teplotný koeficient nižší: na každých 10 °C sa rýchlosť reakcie zvýši 2-krát alebo ešte menej. Následné zníženie reakčnej rýchlosti na nulu indikuje denaturáciu enzýmového bloku. Optimálne teplotné hodnoty pre väčšinu enzýmov sú v rozmedzí 20 - 40 0°C. Termolabilita enzýmov je spojená s ich proteínovou štruktúrou. Niektoré enzýmy sú denaturované už pri teplote okolo 40 0 C, ale hlavná časť z nich je inaktivovaná pri teplotách nad 40 - 50 0 C. Niektoré enzýmy sú inaktivované chladom, t.j. pri teplotách blízkych 0°C dochádza k denaturácii.
Zvýšenie telesnej teploty (horúčka) urýchľuje biochemické reakcie katalyzované enzýmami. Je ľahké vypočítať, že každý stupeň zvýšenia telesnej teploty zvyšuje rýchlosť reakcie asi o 20%. Pri vysokých teplotách okolo 39-40°C treba nehospodárne využitie endogénnych substrátov v bunkách chorého organizmu doplniť potravou. Navyše pri teplote okolo 40°C môže dôjsť k denaturácii niektorých veľmi termolabilných enzýmov, čo narúša prirodzený priebeh biochemických procesov.
Nízka teplota spôsobuje reverzibilnú inaktiváciu enzýmov v dôsledku miernej zmeny v jeho priestorovej štruktúre, ktorá však postačuje na narušenie vhodnej konfigurácie aktívneho centra a molekúl substrátu.
2.2 Závislosť rýchlosti reakcie od pH média
Väčšina enzýmov má špecifickú hodnotu pH, pri ktorej je ich aktivita najväčšia; Nad a pod touto hodnotou pH aktivita týchto enzýmov klesá. Avšak nie vo všetkých prípadoch majú krivky opisujúce závislosť aktivity enzýmu od pH zvonovitý tvar; niekedy môže byť táto závislosť vyjadrená aj priamo. Závislosť rýchlosti enzymatickej reakcie od pH indikuje najmä stav funkčných skupín aktívneho centra enzýmu. Zmena pH média ovplyvňuje ionizáciu kyslých a zásaditých skupín aminokyselinových zvyškov aktívneho centra, ktoré sa podieľajú buď na väzbe substrátu (v kontaktnom mieste), alebo na jeho premene (v katalytickom mieste). ). Špecifický účinok pH teda môže byť spôsobený buď zmenou afinity substrátu k enzýmu, alebo zmenou katalytickej aktivity enzýmu, alebo oboma dôvodmi súčasne.
Väčšina substrátov má kyslé alebo zásadité skupiny, takže pH ovplyvňuje stupeň ionizácie substrátu. Enzým sa prednostne viaže buď na ionizovanú alebo neionizovanú formu substrátu. Je zrejmé, že pri optimálnom pH sú funkčné skupiny aktívneho miesta v najreaktívnejšom stave a substrát je vo forme preferovanej pre väzbu týmito enzýmovými skupinami.
Pri konštrukcii kriviek opisujúcich závislosť aktivity enzýmu od pH sa merania pri všetkých hodnotách pH zvyčajne vykonávajú za podmienok nasýtenia enzýmu substrátom, pretože hodnota Km sa pre mnohé enzýmy mení so zmenami pH.
Krivka charakterizujúca závislosť aktivity enzýmu od pH môže mať obzvlášť jednoduchý tvar v prípadoch, keď enzým pôsobí na elektrostaticky neutrálne substráty alebo substráty, v ktorých nabité skupiny nehrajú významnú úlohu v katalytickom pôsobení. Príkladom takýchto enzýmov je papaín, ako aj invertáza, ktorá katalyzuje hydrolýzu neutrálnych molekúl sacharózy a udržiava konštantnú aktivitu v rozmedzí pH 3,0-7,5.
Hodnota pH zodpovedajúca maximálnej aktivite enzýmu sa nemusí nevyhnutne zhodovať s hodnotou pH charakteristickou pre normálne vnútrobunkové prostredie tohto enzýmu; posledné uvedené môže byť nad aj pod optimom pH. To naznačuje, že vplyv pH na aktivitu enzýmu môže byť jedným z faktorov zodpovedných za reguláciu enzymatickej aktivity v bunke. Keďže bunka obsahuje stovky enzýmov a každý z nich reaguje na zmeny pH inak, hodnota pH v bunke je možno jedným z dôležitých prvkov v komplexnom systéme regulácie bunkového metabolizmu.
2.3 Stanovenie množstva enzýmu jeho aktivitou
) všeobecná stechiometria katalyzovanej reakcie;
) možná potreba kofaktorov - kovových iónov alebo koenzýmov;
) závislosť aktivity enzýmu od koncentrácie substrátu a kofaktora, t.j. hodnoty Km pre substrát aj kofaktor;
) hodnota pH zodpovedajúca maximálnej aktivite enzýmu;
) teplotný rozsah, pri ktorom je enzým stabilný a zachováva si vysokú aktivitu.
Okrem toho je potrebné mať k dispozícii pomerne jednoduchú analytickú techniku, ktorá vám umožní určiť rýchlosť miznutia substrátu alebo rýchlosť objavenia sa reakčných produktov.
Kedykoľvek je to možné, enzýmové testy sa uskutočňujú za štandardných podmienok, ktoré udržujú optimálne pH a koncentrácie substrátu nad koncentráciou nasýtenia; v tomto prípade počiatočná rýchlosť zodpovedá reakcii nultého rádu vzhľadom na substrát a je úmerná iba koncentrácii enzýmu. Pre enzýmy vyžadujúce kofaktory - kovové ióny alebo koenzýmy, musí koncentrácia týchto kofaktorov tiež prekročiť koncentráciu nasýtenia, takže koncentrácia enzýmu je faktorom obmedzujúcim rýchlosť reakcie. Typicky sa meranie rýchlosti tvorby produktu môže vykonávať s väčšou presnosťou ako meranie rýchlosti miznutia substrátu, pretože substrát musí byť typicky prítomný v relatívne vysokých koncentráciách, aby sa zachovala kinetika nultého rádu. Rýchlosť tvorby reakčného produktu (alebo produktov) sa môže merať chemickými alebo fotometrickými metódami. Druhá metóda je pohodlnejšia, pretože vám umožňuje nepretržite zaznamenávať priebeh reakcie na záznamníku.
Podľa medzinárodnej dohody sa za jednotku enzymatickej aktivity považuje množstvo enzýmu schopného spôsobiť konverziu jedného mikromólu substrátu za minútu pri 25 °C za optimálnych podmienok. Špecifická činnosť enzým je počet jednotiek enzymatickej aktivity na 1 mg proteínu. Táto hodnota sa používa ako kritérium pre čistotu enzýmového prípravku; zvyšuje sa, keď sa enzým čistí a dosahuje maximálnu hodnotu pre ideálne čistý prípravok. Pod počet otáčok pochopiť počet molekúl substrátu podstupujúcich konverziu za jednotku času na jednu molekulu enzýmu (alebo na aktívne centrum) v podmienkach, kde je rýchlosť reakcie obmedzená koncentráciou enzýmu.
2.4 Aktivácia enzýmov
Regulácia enzýmov sa môže uskutočňovať prostredníctvom interakcie rôznych biologických zložiek alebo cudzích zlúčenín (napríklad liekov a jedov), ktoré sa bežne nazývajú modifikátory alebo regulátorov enzýmy. Vplyvom modifikátorov na enzým sa môže reakcia urýchliť (aktivátory) alebo spomaliť ( inhibítory).
Aktivácia enzýmu je určená zrýchlením biochemických reakcií, ku ktorým dochádza po pôsobení modifikátora. Jednu skupinu aktivátorov tvoria látky, ktoré ovplyvňujú oblasť aktívneho centra enzýmu. Patria sem enzýmové kofaktory a substráty. Kofaktory (kovové ióny a koenzýmy) sú nielen povinnými štruktúrnymi prvkami komplexných enzýmov, ale v podstate aj ich aktivátormi.
Kovové ióny sú celkom špecifické aktivátory. Niektoré enzýmy často vyžadujú ióny nie jedného, ale niekoľkých kovov. Napríklad pre Na+, K+-ATPázu, ktorá transportuje jednomocné katióny cez bunkovú membránu, sú potrebné ióny horčíka, sodíka a draslíka ako aktivátory.
K aktivácii kovovými iónmi dochádza rôznymi mechanizmami. V niektorých enzýmoch sú súčasťou katalytického miesta. V niektorých prípadoch kovové ióny uľahčujú väzbu substrátu na aktívne centrum enzýmu, čím vytvárajú akýsi mostík. Kov sa často nespája s enzýmom, ale so substrátom, čím vzniká komplex kov-substrát, ktorý je výhodný pre pôsobenie enzýmu.
Špecifickosť účasti koenzýmov na väzbe a katalýze substrátu vysvetľuje ich aktiváciu enzymatických reakcií. Aktivačný účinok kofaktorov je badateľný najmä pri pôsobení na enzým, ktorý nie je nasýtený kofaktormi.
Substrát je tiež aktivátorom v rámci určitých koncentračných limitov. Po dosiahnutí saturačných koncentrácií substrátu sa aktivita enzýmu nezvyšuje. Substrát zvyšuje stabilitu enzýmu a uľahčuje tvorbu požadovanej konformácie aktívneho centra enzýmu.
Kovové ióny, koenzýmy a ich prekurzory a aktívne analógy,
substráty môžu byť v praxi použité ako liečivá aktivujúce enzýmy.
Aktivácia niektorých enzýmov sa môže uskutočniť modifikáciami, ktoré neovplyvňujú aktívne centrum ich molekúl. Existuje niekoľko možností pre túto úpravu:
1) aktivácia neaktívneho predchodcu - proenzým, alebo zymogén. Napríklad premena pepsinogénu na pepsín ;
2) aktivácia pripojením akejkoľvek špecifickej modifikujúcej skupiny k molekule enzýmu;
3) aktivácia disociáciou neaktívneho komplexu proteín-aktívny enzým.
2.5 Inhibícia enzýmov
Existujú činidlá, ktoré môžu viac-menej špecificky interagovať s jedným alebo druhým bočným reťazcom proteínov, čo vedie k inhibícii aktivity enzýmu. Tento jav umožňuje študovať povahu vedľajších aminokyselinových zvyškov zapojených do tejto enzymatickej reakcie. V praxi sa však musia brať do úvahy mnohé jemnosti, ktoré sťažujú a často spochybňujú jednoznačnú interpretáciu výsledkov získaných so špecifickými inhibítormi. V prvom rade, aby bola reakcia s inhibítorom vhodná na štúdium povahy bočných reťazcov zapojených do reakcie, musí spĺňať nasledujúce kritériá:
) byť konkrétny, t.j. inhibítor musí blokovať len požadované skupiny;
) inhibovať aktivitu enzýmu a táto inhibícia by mala byť úplná, keď sa zvyšuje počet modifikovaných skupín;
) činidlo by nemalo spôsobiť nešpecifickú denaturáciu proteínu.
Existujú 2 skupiny inhibítorov: reverzibilné a ireverzibilné. Rozdelenie je založené na kritériu obnovenia aktivity enzýmu po dialýze alebo silnom zriedení roztoku enzýmu inhibítorom.
Podľa mechanizmu účinku sa rozlišuje kompetitívna, nekompetitívna, nekompetitívna, substrátová a alosterická inhibícia.
Konkurenčná inhibícia
Kompetitívna inhibícia bola objavená štúdiom inhibície spôsobenej analógmi substrátu. Ide o inhibíciu enzymatickej reakcie spôsobenej väzbou inhibítora podobnej štruktúry ako substrát na aktívne centrum enzýmu a zabránenie vzniku komplexu enzým-substrát. Pri kompetitívnej inhibícii, inhibítor a substrát, ktoré majú podobnú štruktúru, súťažia o aktívne miesto enzýmu. Zlúčenina molekúl, ktorá je väčšia, je spojená s aktívnym centrom.
Takéto predstavy o mechanizme inhibície boli potvrdené experimentmi na kinetike kompetitívnych inhibičných reakcií. Ukázalo sa teda, že v prípade kompetitívnej inhibície substrátový analóg neovplyvňuje rýchlosť rozkladu už vytvoreného komplexu enzým-substrát, t.j. pri použití "nekonečne veľkého" nadbytku substrátu sa dosiahne rovnaká maximálna rýchlosť ako v prítomnosti, tak aj v neprítomnosti inhibítora. Naopak, inhibítor ovplyvňuje hodnotu disociačnej konštanty a Michaelisovej konštanty. Z toho môžeme vyvodiť záver, že inhibítor reaguje s proteínovými skupinami, ktoré sa tak či onak podieľajú na väzbe substrátu, preto v dôsledku jeho interakcie s týmito skupinami klesá sila väzby substrátu (t.j. počet molekúl enzýmu schopné viazať substrát klesá) .
Neskôr sa ukázalo, že kineticky kompetitívnu inhibíciu môžu spôsobiť nielen analógy substrátu, ale aj iné činidlá, ktorých chemická štruktúra je úplne odlišná od štruktúry substrátu. V týchto prípadoch sa tiež predpokladalo, že činidlo interaguje so skupinou zodpovednou za väzbu substrátu.
Pre kompetitívnu inhibíciu teoreticky existujú dve možnosti:
1) väzbové a katalytické centrá enzýmu sa prekrývajú; inhibítor sa na ne viaže, ale ovplyvňuje len skupiny väzbového centra;
2) väzbové centrum a katalytické centrum v molekule enzýmu sú priestorovo oddelené; inhibítor interaguje s väzbovým miestom.

kde I je inhibítor a KI je disociačná konštanta komplexu enzým-inhibítor.
Relatívna rýchlosť (pomer rýchlosti enzymatickej reakcie meranej v prítomnosti inhibítora (vi) ,
na maximálnu rýchlosť) sa rovná
v i / V = / [E] T
pretože pre celkovú koncentráciu enzýmu je to pravda
[E] T = [E] + +
potom 1 / v i = (Ks / V[S]) (1 + [I] / K I) + 1 / V
Je zrejmé, že ak [I] = KI , potom sa sklon priamky stane dvakrát väčším ako pri závislosti 1/v 0 na [S] (v 0 je rýchlosť enzymatickej reakcie v neprítomnosti inhibítora).
Typ inhibície sa zvyčajne určuje graficky. Kompetitívnu inhibíciu možno najľahšie rozpoznať vynesením Lineweaver-Burkových grafov (t.j. grafov v súradniciach 1/v i a 1/[S]) pri rôznych koncentráciách inhibítora. Pri skutočnej kompetitívnej inhibícii sa získa súbor priamych čiar, ktoré sa líšia v dotyčnici uhla sklonu a pretínajú ordinátovú os (1/v i os) v jednom bode. Pri akejkoľvek koncentrácii inhibítora je možné použiť takú vysokú koncentráciu substrátu, že aktivita enzýmu bude maximálna.
Príkladom kompetitívnej inhibície je účinok rôznych látok na aktivitu sukcinátdehydrogenázy. Tento enzým je súčasťou cyklického enzýmového systému – Krebsovho cyklu. Jeho prirodzeným substrátom je sukcinát a podobným konkurenčným inhibítorom je oxalacetát, medziprodukt rovnakého Krebsovho cyklu:
Podobným kompetitívnym inhibítorom sukcinátdehydrogenázy je kyselina malónová, ktorá sa často používa v biochemických štúdiách.
Princíp kompetitívnej inhibície je základom pôsobenia mnohých farmakologických liečiv, pesticídov používaných na ničenie poľnohospodárskych škodcov a chemických bojových látok.
Napríklad skupina anticholínesterázových liečiv, ktoré zahŕňajú deriváty kvartérnych amóniových báz a organofosforové zlúčeniny, sú kompetitívnymi inhibítormi enzýmu cholínesterázy vo vzťahu k jeho substrátu acetylcholínu. Cholínesteráza katalyzuje hydrolýzu acetylcholínu, mediátora cholinergných systémov (neuromuskulárne synapsie, parasympatický systém atď.). Anticholínesterázové látky súťažia s acetylcholínom o aktívne miesto enzýmu, viažu sa naň a vypínajú katalytickú aktivitu enzýmu. Lieky ako prozerín, fyzostigmín, sevin inhibujú enzým reverzibilne a organofosforové lieky ako armín, nibufín, chlorofos, soman pôsobia ireverzibilne, fosforylujúc katalytickú skupinu enzýmu. V dôsledku ich pôsobenia sa acetylcholín hromadí v tých synapsiách, kde je sprostredkovateľom nervového vzruchu, t.j. telo sa otrávi nahromadeným acetylcholínom. Účinok reverzibilných inhibítorov sa postupne vytráca, pretože čím viac acetylcholínu akumuluje, tým rýchlejšie vytláča inhibítor z aktívneho centra cholínesterázy. Toxicita ireverzibilných inhibítorov je neporovnateľne vyššia, preto sa používajú na ničenie poľnohospodárskych škodcov, domáceho hmyzu a hlodavcov (napríklad chlorofos) a ako chemické bojové látky (napríklad sarín, soman atď.).
Nekonkurenčná inhibícia
Pri nekompetitívnej inhibícii špecifický inhibítor neovplyvňuje disociačnú konštantu komplexu enzým-substrát. Na druhej strane, maximálna dosiahnuteľná rýchlosť reakcie je nižšia v prítomnosti inhibítora ako v jeho neprítomnosti, dokonca aj pri nekonečne veľkom prebytku substrátu. Prítomnosť inhibície dokazuje, že inhibítor sa viaže na proteín. Invariantnosť disociačnej konštanty v prítomnosti aj neprítomnosti inhibítora zase naznačuje, že na rozdiel od substrátu sa inhibítor viaže na inú skupinu. Z teoretického hľadiska možno mechanizmus takejto inhibície interpretovať rôznymi spôsobmi.
a) Väzbové centrum a katalytické centrum enzýmu sú odlišné. V tomto prípade inhibítor spojený s katalytickým centrom znižuje aktivitu enzýmu a dosiahnuté maximum
rýchlosť bez ovplyvnenia tvorby komplexu enzým-substrát.
b) Väzbové centrum a katalytické centrum sa prekrývajú o
povrchu enzýmu a inhibítor sa viaže na iné skupiny proteínu. V dôsledku väzby inhibítora na povrch enzýmu sa informácia o proteíne mení a stáva sa nepriaznivou pre katalýzu.
c) Inhibítor sa neviaže ani na katalytické miesto, ani na väzbové miesto a neovplyvňuje konformáciu proteínu. Môže však lokálne zmeniť distribúciu náboja v oblasti povrchu proteínu. Inhibícia aktivity môže nastať aj v tomto prípade, ak sa napríklad stane nemožná ionizácia skupín nevyhnutných na prejavenie aktivity, alebo ak naopak dôjde k ionizácii skupín aktívnych len v neionizovanej forme. Tento jav sa pozoruje hlavne pri použití silne kyslých alebo silne alkalických činidiel.
Inhibítor a substrát neovplyvňujú vzájomnú väzbu na enzým, ale komplexy enzýmov obsahujúce inhibítor sú úplne neaktívne. V tomto prípade môžeme predpokladať tieto základné fázy:

v i / V = / [E] T
[E] T = [E] + + +
/ v i = (Ks / V [S]) (1 + [I] / K I) + (1 / V) (1 + [I] / K I)
Ak [I] = K I, sklony čiar a ordináta priesečníka so zvislou osou sa zdvojnásobia v porovnaní s 1/v 0.
Nekompetitívnymi inhibítormi sú napríklad kyanidy, ktoré sa silne viažu na trojmocné železo, ktoré je súčasťou katalytického miesta hemínového enzýmu – cytochróm oxidázy. Blokáda tohto enzýmu vypne dýchací reťazec a bunka odumiera. Medzi nekompetitívne inhibítory enzýmov patria ióny ťažkých kovov a ich organické zlúčeniny. Preto sú ióny ťažkých kovov ortuti, olova, kadmia, arzénu a iných veľmi toxické. Blokujú napríklad SH skupiny zahrnuté v katalytickom mieste enzýmu.
Nekompetitívnymi inhibítormi sú kyanidy, ktoré sa pevne viažu na trojmocné železo, ktoré je súčasťou katalytického miesta hemínového enzýmu – cytochróm oxidázy. Blokáda tohto enzýmu vypne dýchací reťazec a bunka odumiera. Účinok nekompetitívneho inhibítora nie je možné odstrániť nadbytkom substrátu (ako účinok kompetitívneho), ale iba látkami, ktoré inhibítor viažu - reaktivátory.
Nekompetitívne inhibítory sa používajú ako farmakologické činidlá, jedovaté látky na kontrolu poľnohospodárskych škodcov a na vojenské účely. V medicíne sa používajú lieky obsahujúce ortuť, arzén a bizmut, ktoré nekompetitívne inhibujú enzýmy v bunkách tela alebo patogénnych baktérií, čo určuje jeden alebo druhý ich účinok. Počas intoxikácie je pomocou reaktivátorov možná väzba jedu alebo jeho vytesnenie z komplexu enzým-inhibítor. Patria sem všetky komplexóny obsahujúce SH (cysteín, dimerkaptopropanol), kyselina citrónová, kyselina etyléndiamíntetraoctová atď.
Nekonkurenčná inhibícia
Tento typ inhibície sa v literatúre nazýva aj antikonkurenčný. alebo pridružená inhibícia , najčastejšie sa však používa termín nekompetitívna inhibícia. Charakteristickým znakom tohto typu inhibície je, že inhibítor nie je schopný viazať sa na enzým, ale viaže sa na komplex enzým-substrát.
V prípade nekompetitívnej inhibície je komplex obsahujúci inhibítor neaktívny:

v i / V = / [E]
[E] T = [E] + +
/ v i = Ks / V[S] + (1 / V) (1 + [I] / K I)
Inhibícia substrátu
Substrátová inhibícia je inhibícia enzymatickej reakcie spôsobenej nadbytkom substrátu. Táto inhibícia nastáva v dôsledku tvorby komplexu enzým-substrát, ktorý nie je schopný podstúpiť katalytické transformácie.Komplex ES 2 je neproduktívny a robí molekulu enzýmu neaktívnou. Inhibícia substrátu je spôsobená nadbytkom substrátu, a preto sa zmierňuje, keď jeho koncentrácia klesá.
Allosterická inhibícia
Alosterická regulácia je charakteristická len pre špeciálnu skupinu enzýmov s kvartérnou štruktúrou, ktoré majú regulačné centrá pre väzbu alosterických efektorov. Ako alosterické inhibítory pôsobia negatívne efektory, ktoré inhibujú premenu substrátu v aktívnom mieste enzýmu. Pozitívne alosterické efektory naopak urýchľujú enzymatickú reakciu, a preto sú klasifikované ako alosterické aktivátory. Alosterické efektory enzýmov sú najčastejšie rôzne metabolity, ako aj hormóny, ióny kovov a koenzýmy. V zriedkavých prípadoch úlohu alosterického efektora enzýmov vykonávajú molekuly substrátu.
Mechanizmus účinku alosterických inhibítorov na enzým spočíva v zmene konformácie aktívneho centra. Zníženie rýchlosti enzymatickej reakcie je buď dôsledkom zvýšenia Km alebo výsledkom zníženia maximálnej rýchlosti Vmax pri rovnakých saturačných koncentráciách substrátu, t.j. enzým je čiastočne nečinný.
Allosterické enzýmy sa líšia od iných enzýmov tým, že majú špeciálnu krivku v tvare písmena S závislosti rýchlosti reakcie od koncentrácie substrátu. Táto krivka je podobná krivke saturácie hemoglobínu kyslíkom, naznačuje, že aktívne centrá podjednotiek nefungujú autonómne, ale kooperatívne, t.j. afinita každého nasledujúceho aktívneho centra k substrátu je určená stupňom nasýtenia predchádzajúcich centier. Koordinovanú prácu centier určujú alosterické efektory.
Alosterická regulácia sa prejavuje vo forme inhibície konečným produktom prvého enzýmu v reťazci. Štruktúra konečného produktu po sérii premien východiskovej látky (substrátu) nie je podobná substrátu, preto konečný produkt môže pôsobiť na východiskový enzým reťazca len ako alosterický inhibítor (efektor). Navonok je takáto regulácia podobná regulácii spätnoväzbovým mechanizmom a umožňuje kontrolovať výťažok konečného produktu, v prípade akumulácie ktorého sa práca prvého enzýmu v reťazci zastaví. Napríklad aspartát-karbamoyltransferáza (ACTáza) katalyzuje prvú zo šiestich reakcií pri syntéze cytidíntrifosfátu (CTP). CTP je alosterický inhibítor AKTázy. Preto, keď sa akumuluje CTP, AKTáza je inhibovaná a ďalšia syntéza CTP sa zastaví. Bola objavená alosterická regulácia enzýmov hormónmi. Napríklad estrogény sú alosterickým inhibítorom enzýmu glutamátdehydrogenázy, ktorý katalyzuje deamináciu kyseliny glutámovej.
Teda aj najjednoduchšia kinetická rovnica enzymatickej reakcie obsahuje niekoľko kinetických parametrov, z ktorých každý závisí od teploty a prostredia, v ktorom reakcia prebieha.
Inhibítory nám umožňujú pochopiť nielen podstatu enzymatickej katalýzy, ale sú aj jedinečným nástrojom na štúdium úlohy jednotlivých chemických reakcií, ktoré je možné špecificky vypnúť pomocou inhibítora daného enzýmu.
3. Niektoré zariadenia vhodné na stanovenie počiatočných reakčných rýchlostí
Mnohé problémy enzymatickej kinetiky vedú k stanoveniu počiatočných reakčných rýchlostí (v 0). Hlavnou výhodou tejto metódy je, že hodnoty v 0 stanovené v počiatočnom okamihu poskytnú najpresnejšie vyjadrenie aktivity študovaných enzýmov, pretože hromadiace sa reakčné produkty ešte nestihnú pôsobiť. inhibičný účinok na enzým a navyše je reagujúci systém v stave stacionárnej rovnováhy .
V laboratórnej praxi sa však pri použití konvenčných spektrofotometrických, titrimetrických alebo iných techník na zaznamenávanie priebehu takýchto reakcií stratí v najlepšom prípade až 15-20 z počiatočného času na pridanie enzýmu do substrátu, miešanie reakčného systému, inštaláciu bunka atď. A to je neprijateľné, pretože dotyčnica je v tomto prípade privedená do bodu, kde tan ά 2< tg ά 1 . Не компенсируется потеря начального времени и при математической обработке таких кривых при записи выхода v 0 на максимальный уровень (V). Кроме того, протекание реакций без konštantné miešanie je ďalej komplikované kolísaním koncentrácií činidiel podľa objemu.
Jednoduché zariadenia navrhnuté nižšie pre spektrofotometer, pH meter a podobne môžu výrazne znížiť zdroje uvedených chýb pri určovaní v 0.
3.1 Zariadenie pre spektrofotometer
Spektrofotometrické zariadenie pozostáva z dávkovača 1, rotujúceho teflónového vlákna 2 (miešadlo) a uzamykacieho veka 3.
Dávkovač je mikropipeta, ktorej jeden koniec je tvarovaný s ihlou 4, druhý s rozšírením 5 (aby sa zabránilo vniknutiu enzýmu do gumenej špičky 6).
V teflónovom kryte 3, ktorý pokrýva spektrálny článok 7, sú dva otvory: jeden (8) v strede krytu, druhý (9) nad stredom medzery medzi nepriehľadnou stenou článku 7 a svetlom. nosník 10. Teflónová rúrka 11 (vnútorný priemer 1 -1,5 mm) jeden koniec je upevnený v otvore 9, druhý - na pevnom výstupku 12 pred rotorom motora 13. Teflónový závit 2 je vložený do rúrky (hrúbka závitu 0,5 -0,6 mm). Jeden koniec vlákna je upevnený na rotujúcom rotore motora 13, druhý - prechádzajúci do kyvety 7 - je tvarovaný do tvaru špirály (na zlepšenie miešania). Poloha závitu je určená uzamykacím krytom 3, bez ohľadu na odstránenie motora, čo je vhodné pre prácu, ktorá vyžaduje časté výmeny kyviet.
Princíp činnosti. Kremenná kyveta spektrofotometra 7 je naplnená substrátom 14 (asi 1,5-2,0 ml), vložená do termostatického držiaka kyvety spektrofotometra, uzavretá vekom 3 s rotujúcim teflónovým závitom 2, ktorý je ponorený v substráte 14, a všetky ďalšie operácie sa vykonávajú vo svetelnom lúči spektrofotometra a zaznamenávajú sa na záznamníku.
Na začiatku práce sa substrát premieša a zapisovacie pero napíše rovnomernú vodorovnú (alebo „nulovú“) čiaru. Dávkovač (s enzýmom) sa vloží do otvoru 8 (ihla je ponorená do roztoku substrátu 14), rýchlym stlačením hrotu 6 sa do substrátu zavedie enzým (zvyčajne asi 0,03-0,05 ml) a dávkovač sa odstránený. Miešanie zložiek končí za 2,5-3 s a zapisovacie pero zaznamenáva začiatok reakcie odchýlkou krivky optickej hustoty (ΔA) od času.
Toto zariadenie tiež umožňuje odoberať vzorky z reakčného systému na analýzu; pridať do systému inhibítory a aktivátory; meniť reakčné podmienky (zmeniť pH, iónovú silu atď.) bez narušenia záznamu priebehu reakcie, čo sa ukazuje ako veľmi výhodné napríklad pri štúdiu štiepenia n-NPF „kyslými“ fosfatázami, kde dochádza k štiepeniu n-NFF sa uskutočňuje pri pH 5,0 (alebo pH 6-7) a aktivita enzýmu je určená akumuláciou n-nitrofenolátové ióny pri pH 9,5-10,0.
Takéto zariadenie je tiež vhodné na vykonávanie spektrofotometrickej titrácie enzýmov atď.
3.2 Zariadenie pre pH meter
Zariadenie pre pH meter pozostáva z upraveného hrotu prietokovej elektródy 1, polomikročlánku 2, dávkovača 3 a elektronického obvodu na pripojenie pH metra k záznamníku. Okrem toho zariadenie obsahuje štandardnú elektródu pH metra (4), kryt držiaka článku (5), termostatickú prietokovú komoru (6), roztok substrátu (7), pasívny magnet (8) a aktívny magnet ( 9).
Štandardný hrot prietokovej elektródy pH metra (LPU-01) sa nahradí teflónovou trubicou 1 (vnútorný priemer 1,3-1,5 mm) a naplní sa azbestovou niťou, vopred upravenou nasýteným roztokom KCl. Hustota náplne závitu sa nastaví tak, aby prietok roztoku KCl cez trubicu bol blízky prietoku pôvodnej nemodifikovanej elektródy. Táto výmena hrotu umožňuje zmenšiť veľkosť počiatočnej pracovnej bunky z 20-25 na 2 ml, čo umožňuje použiť minimálne objemy (1,5 ml) roztokov drahých biochemických liečiv.
Elektronický obvod na pripojenie pH metra (LPU-01) k záznamníku pozostáva zo zdroja (12 V DC batéria), striedavého odporu vodiča R 1 (10 - 100 Ohm), ktorý nastavuje napätie 9 V na Zenerova dióda D809 podľa hodnoty voltmetra, striedavý odpor vodiča R 2 (15-150 Ohm), ktorý reguluje nastavenie „nuly“ (referenčný bod) hodnôt pH metra na stupnici záznamníka, a premenlivý odpor vodiča R 3 (35-500 ohmov), ktorý reguluje rozsah expanzie (zosilnenia) hodnôt pH stupnice - merače na záznamníku. Obvod funguje spoľahlivo, kým napätie zdroja neklesne pod 9 V.
Princíp činnosti. Do kyvety (sklenený valec 1,7 x 2,4 cm) sa pridá 1,5 ml substrátu a kyveta sa upevní na uzatváracie veko 5. Zapne sa miešanie 9 a zapisovacie pero napíše rovnomernú (základnú) referenčnú čiaru. Pomocou dávkovača sa k substrátu pridá 0,03 ml roztoku enzýmu a zapisovacie pero zaznamená začiatok reakcie odchýlkou krivky pH oproti času (t).
Takéto zariadenie nenahrádza pH stat, ale s prihliadnutím na možnosť rozšírenia stupnice pH metra umožňuje spoľahlivo zaznamenať drobné zmeny pH 0,004-0,005.
3.3 Nomogramové pravítka, vhodné na určenie počiatočnej rýchlosti
Značnú zložitosť pri určovaní počiatočnej rýchlosti pri tangentovej metóde predstavuje výpočet pomerov zmien koncentrácií činidiel (Δ[S]) za jednotku času (Δt), t.j. vyjadrenie v 0 v M/min z podmienok, ktoré
v0 = lim Δ[S] / Δt, pri t 0.
V praxi takýto postup zvyčajne pozostáva z troch alebo štyroch samostatných operácií: k počiatočnému úseku krivky priebehu reakcie sa nakreslí dotyčnica, potom sa počet jednotiek zaznamenanej hodnoty (optická hustota, uhol natočenia atď.) za odpočíta sa určitý časový interval a ten sa prenesie na jednotku času a nakoniec sa prepočítajú údaje zapisovača pre zmenu koncentrácie činidla za 1 minútu (M/min). Navrhované dva typy nomogramového pravítka nám umožňujú tento postup zjednodušiť.
Obdĺžnikové pravítko. v 0 je pomer Δ[S]/Δt, t.j. tg ά, kde ά je uhol sklonu dotyčnice k časovej osi t. Tá istá dotyčnica je aj prepona príslušného pravouhlého trojuholníka s nohami [S] a it. Čím väčšie v 0, tým strmší je sklon dotyčnice. Ak sa teda obmedzíme na určitý časový interval, napríklad 1 minútu, dostaneme sériu pravouhlých trojuholníkov s rôznymi hodnotami nohy [S] (v skutočnosti rôzne hodnoty v 0). Ak kalibrujete obe nohy: horizontálne - v časových jednotkách (1 min) a vertikálne - v jednotkách zmeny koncentrácií činidiel, napríklad v milimoloch (mM), a výsledné segmenty nanesiete na vhodný formát vyrobený z priehľadného materiálu (plexisklo asi 2 mm hrubé), potom môžete získať vhodné pravítko na určenie počiatočných reakčných rýchlostí. Všetky čísla a čiary sú aplikované na zadnú stranu pravítka, aby sa eliminovali chyby paralaxy pri určovaní v 0 .
Postup stanovenia v 0 sa v tomto prípade redukuje na dve jednoduché operácie: k počiatočnému úseku kinetickej krivky t sa nakreslí dotyčnica. 2 a skombinujte nulový bod vodorovného ramena t pravítka so začiatkom dotyčnice, pokračovanie dotyčnice teraz pretína koncentračnú stupnicu [S] v bode, ktorý určuje hodnotu v 0 v M/min (s horizontálna poloha nohy t. Nie sú potrebné žiadne ďalšie operácie.
Oblúkové pravítko. Postup stanovenia v 0 možno zjednodušiť na jednu operáciu, ak sa stupnica koncentrácie vynesie pozdĺž oblúka s určitým polomerom.
Rovná („základná“) čiara 2 sa nanesie na dosku z priehľadného materiálu (všetky čísla a čiary sú nanesené aj na zadnej strane pravítka) a od nulového bodu (t=0, min) tejto čiary polomer rovný dĺžke ramena t=1 min [ , nakreslite oblúk [S] zhora nadol, pozdĺž ktorého je vynesená stupnica zmien v koncentráciách činidla (napríklad substrátu v mM).
Opísané typy pravítok, prístroj pre spektrofotometer a pH meter sa už niekoľko rokov používajú na stanovenie počiatočných rýchlostí reakcií (v 0), pri štúdiu substrátovej špecifickosti enzýmov, na spektrofotometrickú titráciu atď.
Záver
Táto práca skúmala oblasť enzymológie, ktorá študuje závislosť rýchlosti chemických reakcií katalyzovaných enzýmami od množstva environmentálnych faktorov. Za zakladateľov tejto vedy sa právom považujú Michaelis a Menten, ktorí zverejnili svoju teóriu všeobecného mechanizmu enzymatických reakcií odvodili rovnicu, ktorá sa stala základným princípom všetkých kinetických štúdií enzýmov a slúži ako východiskový bod pre akýkoľvek kvantitatívny popis pôsobenia enzýmov. Pôvodná Michaelis-Mentenova rovnica je rovnica hyperboly; Lineweaver a Burke prispeli ku kinetike, ktorí transformovali Michaelisovu-Mentenovu rovnicu a získali graf priamky, z ktorého možno najpresnejšie určiť hodnotu Vmax.
V priebehu času sa zmena rýchlosti enzymatickej reakcie v enzymatickej reakcii za experimentálnych podmienok znižuje. Zníženie rýchlosti môže nastať v dôsledku viacerých faktorov: zníženie koncentrácie substrátu, zvýšenie koncentrácie produktu, ktorý môže mať inhibičný účinok, zmeny pH roztoku, zmeny teploty prostredia. Takže s každým zvýšením teploty o 10 °C sa rýchlosť reakcie zvýši 2-krát alebo dokonca menej. Nízka teplota reverzibilne inaktivuje enzýmy. Závislosť rýchlosti enzymatickej reakcie od pH udáva stav funkčných skupín aktívneho centra enzýmu. Každý enzým reaguje inak na zmeny pH. Chemické reakcie možno zastaviť pôsobením na ne rôznymi typmi inhibície. Počiatočnú rýchlosť reakcie je možné rýchlo a presne určiť pomocou zariadení, ako sú nomogramové pravítka, zariadenie pre spektrofotometer a pH meter. To umožňuje čo najpresnejšie znázornenie aktivity študovaných enzýmov.
To všetko sa dnes aktívne používa v lekárskej praxi.
Zoznam použitých zdrojov
1. Belyasova N.A. Biochémia a molekulárna biológia. - Mn.: knižný dom, 2004. - 416 s., ill.
Keleti T. Základy enzymatickej kinetiky: Trans. z angličtiny - M.: Mir, 1990. -350 s., ill.
3. Knorre D.G. Biologická chémia: Učebnica. pre chémiu, biol. a med špecialista. univerzity - 3. vydanie, rev. - M.: Vyššie. školy 2002. - 479 s.: chor.
4. Krupjanenko V.I. Vektorová metóda na znázornenie enzymatických reakcií. - M.: Nauka, 1990. - 144 s.
5. Leninger A. Biochémia. Molekulový základ bunkovej štruktúry a funkcie: Trans. z angličtiny - M.: Mir, 1974.
6. Stroev E.A. Biologická chémia: Učebnica pre liečivá. Institute and Pharmac. fak. med. Inst. - M.: Vyššia škola, 1986. - 479 s., ill.
Severin E.S. Biochémia. A. - 5. vyd. - M.: GEOTAR - Media, 2009. - 786 s., ill.
ENZYMATÍVNA REAKČNÁ KINETIKA
študuje vzorce prechodu enzymatických reakcií v čase, ako aj ich mechanizmus; kapitola chemická kinetika.
Katalytický cyklus premeny látky S (substrát) na produkt P pôsobením enzýmu E prebieha tvorbou medziproduktov. spoj. X i:
Kde ki- rýchlostné konštanty jednotlivých elementárnych stupňov,
tvorba komplexu enzým-substrát X 1 (ES, Michaelisov komplex).
Pri danej teplote závisí rýchlosť reakcie od koncentrácií enzýmu, substrátu a zloženia média. Existuje stacionárna, predstacionárna a relaxačná kinetika enzymatických reakcií.
Stacionárna kinetika. V stacionárnom stave cez medziľahlé spojenia. (dX i/dt= 0, i = 1, ..., n) a s nadbytkom substrátu, kde [S]0 a [E]0 sú počiatočné koncentrácie. substrátu a enzýmu, kinetika procesu je charakterizovaná konštantnou, časovo invariantnou úrovňou koncentrácií. spojenie a výraz pre rýchlosť procesu v 0, tzv počiatočná stacionárna rýchlosť, má tvar (Michaelis-Mentenova rovnica):
 (1)
(1)
kde sú hodnoty k cat and Km -> funkcie rýchlostných konštánt elementárnych stupňov a sú dané rovnicami:

Hodnota k kat
volal účinný katalytický rýchlostná konštanta procesu, parameter Km -> Michaelis konštanta. k cat hodnota
určené množstvom max. pomalé fázy katalytického procesu okresy a niekedy tzv počet otáčok enzýmu (enzýmový systém); k kat
charakterizuje počet katalytických cyklov vykonaných enzýmovým systémom za jednotku času. Naíb. bežné, majúce hodnotu k kat. pre konkrétne substráty v rozsahu 10 2 -10 3 s -1. Typické hodnoty Michaelisovej konštanty ležia v rozmedzí 10 -3 - 10 -4 M.
Pri vysokých koncentráciách substrátu, kedy, t.j. rýchlosť cirkulácie nezávisí od koncentrácie substrátu a dosahuje konštantnú hodnotu, tzv. Max. rýchlosť. Z grafického hľadiska je rovnica Michaelis-Menten hyperbolou. Dá sa linearizovať metódou dvojitých reciprokál (Linewere-Burkova metóda), t.j. zostrojením závislosti 1/v na 1/[S] 0, alebo inými metódami. Lineárny tvar rovnice (1) má tvar:
 (2)
(2)
Umožňuje vám graficky určiť hodnoty K m a v max (obr. 1).

Ryža. 1. Graf lineárnej transformácie Michaelisovej - Mentenovej rovnice v dvojitých reciprokáloch (podľa Lineweavera - Burkeho).
Rozsah Km > sa číselne rovná koncentrácii substrátu, pri ktorej je rýchlosť cirkulácie rovnaká K mčasto slúži ako miera afinity substrátu a enzýmu, ale to platí len vtedy, ak
množstvá Km > A sa líšia v závislosti od hodnôt pH. Je to spôsobené schopnosťou skupín molekúl enzýmu zapojených do katalýzy meniť svoj ionizačný stav a tým aj svoju katalytickú aktivitu. efektívnosť. V najjednoduchšom prípade má zmena pH za následok protonáciu alebo deprotonáciu aspoň dvoch ionizovateľných skupín enzýmu, ktorý sa podieľa na katalýze. Ak je v tomto prípade len jedna forma komplexu enzým-substrát (napríklad ESH) z troch možných foriem (ES, ESH a ESH 2) schopná premeny na produkt roztoku, potom závislosť rýchlosť pH je opísaná vzorcom:

Kde f = 1 + / A f" = 1 +
+K" b />-T. volal pH-funkcie Michaelis, a Ka, K b A K" a, K" b -> ionizačné konštanty skupín a a bresp. zadarmo enzým a komplex enzým-substrát. V súradniciach lg - pH táto závislosť je znázornená na obr. 2 a dotyčnice uhlov sklonu dotyčníc k vzostupnej nezávislej od pH a klesajúcej vetve krivky by sa mali rovnať +1, 0 a -1. Z takéhoto grafu môžete určiť hodnoty pK a skupiny zapojené do katalýzy.

Ryža. 2. Závislosť katalyzátora konštanty od pH po logaritmické. súradnice
Rýchlosť enzymatickej reakcie nie vždy zodpovedá rovnici (1). Jedným z najbežnejších prípadov je účasť alosterika v reakcii. enzýmy (pozri enzýmové regulátory), pre ktoré je závislosť stupňa nasýtenia enzýmu od [S] 0 nehyperbolická. znak (obr. 3). Tento jav je spôsobený kooperativitou väzby substrátu, t.j. keď väzba substrátu na jedno z miest makromolekuly enzýmu zvyšuje (pozitívna kooperativita) alebo znižuje (negatívna kooperativita) afinitu k substrátu iného miesta.

Ryža. H Závislosť stupňa nasýtenia enzýmu substrátom od koncentrácie substrátu s pozitívnou (I) a negatívnou (II) kooperativitou, ako aj v jeho neprítomnosti (III).
Kinetika pred ustáleným stavom. Pri rýchlom miešaní roztokov enzýmov a substrátov v časovom intervale 10 -6 -10 -1 s možno pozorovať prechodné procesy predchádzajúce vzniku stabilného stacionárneho stavu. V tomto predstacionárnom režime, pri použití veľkého prebytku substrátu, diferenciálneho systému. Rovnica popisujúca kinetiku procesov je lineárna. Riešenie tohto typu lineárneho diferenciálneho systému. Rovnica je daná súčtom exponenciálnych členov. Takže pre kinetiku V schéme uvedenej vyššie má kinetika akumulácie produktu tvar:

kde i ->, b, a n -> funkcie elementárnych rýchlostných konštánt; -korene zodpovedajúcej charakteristiky. úrovni.
Recipročné množstvo je tzv charakteristický čas spracovania:
Pre rieku tečúcu za účasti nintervalov. pripojenie, môžete získať ncharakteristiky. krát
Štúdium kinetiky enzymatickej reakcie v predstacionárnom režime nám umožňuje získať predstavu o podrobnom mechanizme katalytických reakcií. cyklu a určiť rýchlostné konštanty elementárnych fáz procesu.
Experimentálne sa študuje kinetika enzymatickej reakcie v predstacionárnom režime pomocou metódy zastaveného prúdu (pozri. tryskové kinetické metódy), umožňujúce zmiešanie zložiek roztoku do 1 ms.
Relaxačná kinetika. Pri rýchlom rušivom účinku na systém (zmena teploty, tlaku, elektrického poľa) závisí čas potrebný na to, aby systém dosiahol nový rovnovážny alebo stacionárny stav od rýchlosti procesov, ktoré podmieňujú katalytickú reakciu. enzymatický cyklus.
Systém rovníc popisujúcich kinetiku procesu je lineárny, ak je posunutie z rovnovážnej polohy malé. Riešenie sústavy vedie k závislostiam koncentrácií zložiek, rozkl. etapy procesu vo forme súčtu exponenciálnych členov, ktorých exponenty majú charakter relaxačných časov. Výsledkom štúdie je spektrum relaxačných časov zodpovedajúce počtu intervalov. spojenia zúčastňujúce sa procesu. Relaxačné časy závisia od rýchlostných konštánt základných štádií procesov.
Relaxačné techniky kinetika umožňuje určiť rýchlostné konštanty jednotlivých elementárnych stupňov premeny medziproduktov. Metódy na štúdium kinetiky relaxácie sa líšia. rozlíšenie: absorpcia ultrazvuku - 10 -6 -10 -10
s, teplotný skok - 1O -4 -10 -6 s, elektrická metóda. impulz - 10 -4 -10 -6 s, tlakový skok - 10 -2 s. Pri štúdiu kinetiky enzymatických reakcií našla uplatnenie metóda teplotného skoku.
Makrokinetika enzymatických procesov. Vývoj metód výroby heterogénnych katalyzátorov imobilizáciou enzýmov pri rozklade. médiá (pozri Imobilizované enzýmy) si vyžiadala analýzu kinetiky procesov s ohľadom na prenos hmoty substrátu. Kinetika reakcií bola študovaná teoreticky a experimentálne, berúc do úvahy účinky difúznej vrstvy a pre systémy s intradifúznymi ťažkosťami počas distribúcie enzýmu v nosiči.
V podmienkach, kde je kinetika procesu ovplyvnená difúznym prenosom substrátu, katalytický. účinnosť systému klesá. Faktor účinnosti sa rovná pomeru hustoty toku produktu za podmienok enzymatického toku s difúzne zníženou koncentráciou substrátu k toku, ktorý by sa mohol realizovať bez obmedzení difúzie. V čisto difúznej oblasti, keď je rýchlosť procesu určená prenosom hmoty substrátu, je faktor účinnosti pre systémy s vonkajšou inhibíciou difúzie nepriamo úmerný modulu difúzie:

Kde
hrúbka difúznej vrstvy, D - koeficient. substrátová difúzia.
Pre systémy s intradifúznou inhibíciou v oblastiach prvého poriadku

kde Ф T- bezrozmerný modul (Thiele modul).
Pri analýze kinetiky vzory v enzymatických reaktoroch sú široko teoretické. a experimentovať. Boli vyvinuté „ideálne“ modely reaktorov: prietokový reaktor (prietokový reaktor s ideálnym miešaním), prietokový reaktor s ideálnym objemom a membránový reaktor.
Kinetika multienzýmových procesov. V tele (bunke) enzýmy nepôsobia izolovane, ale katalyzujú reťazce transformácie molekúl. R-ióny v multienzýmových systémoch s kinetickou. názory možno považovať za konzistentné. procesy, špecifické Charakteristickým znakom sú enzýmy každého z etáp:
Kde ,
resp. max, rýchlosť procesu a Michaelisova konštanta i etapa okresu, resp.
Dôležitou črtou procesu je možnosť vytvorenia stabilného stacionárneho stavu. Podmienkou jej vzniku môže byť nerovnosť > v 0 , kde v 0 je rýchlosť limitného stupňa, charakterizovaná najmenšou rýchlostnou konštantou a tým určujúca rýchlosť všetkého, čo nasleduje. proces. V ustálenom stave sú koncentrácie metabolitov po limitnom štádiu nižšie ako Michaelisova konštanta zodpovedajúceho enzýmu.
Špecifické skupinu multienzýmových systémov tvoria systémy, ktoré vykonávajú oxidačno-redukčnú činnosť. r-ióny za účasti proteínových nosičov elektrónov. Špecifické formy nosičov štruktúry, komplexy s deterministickou postupnosťou prenosu elektrónov. Kinetický. popis tohto druhu systémov považuje stav obvodov s rozkladom za nezávislú premennú. stupeň elektrónovej populácie.
Aplikácia. F.r. K. má široké využitie vo výskumnej praxi na štúdium mechanizmov pôsobenia enzýmov a enzýmových systémov. Prakticky významnou oblasťou vedy o enzýmoch je inžinierska enzymológia, pracuje s pojmami F. r. pre optimalizáciu biotechn. procesy.
Lit.: Poltorak O.M., Chukhrai E.S., Fyzikálne-chemické základy enzymatickej katalýzy, M., 1971; Berezin I.V., Martinek K., Základy fyzikálnej chémie enzymatickej katalýzy, M., 1977; Varfolomeev S. D., Zaitsev S. V., Kinetické metódy v biochemickom výskume, M.. 1982. S. D. Varfolomejev.
Chemická encyklopédia. - M.: Sovietska encyklopédia. Ed. I. L. Knunyants. 1988 .
Pozrite sa, čo je "ENZYMATÍVNA REAKČNÁ KINETIKA" v iných slovníkoch:
Katalytický rádio cyklické proces pozostávajúci z množstva elementárnych pohybov, ktorých rýchlosti popisuje zákon hromadnej akcie. Tento zákon má jednoduchú formu pre ideálne zmesi plynov, ideálne kvapaliny a ideálne povrchové vrstvy.... ... Chemická encyklopédia
Kinetika chemických reakcií, štúdium chemických procesov, zákonitosti ich priebehu v čase, rýchlosti a mechanizmy. Najdôležitejšie oblasti modernej chémie a chemickej vedy sú spojené so štúdiom kinetiky chemických reakcií... ... Veľká sovietska encyklopédia
CHEMICKÁ KINETIKA- (z gréckeho hnutia kinesis), odbor teoretickej chémie venujúci sa štúdiu zákonov chémie. reakcie. Je možné identifikovať niekoľko druhov chemikálií. interakcie a v prvom rade odlíšiť reakcie prebiehajúce v homogénnom (homogénnom) prostredí od reakcií... ... Veľká lekárska encyklopédia
- (biokatalýza), zrýchlenie biochem. dávky s účasťou bielkovinových makromolekúl nazývaných enzýmy. F. k. je typ katalýzy, hoci pojem fermentácia (fermentácia) je známy už v staroveku, keď ešte neexistoval pojem chémia. katalýza. Najprv… … Chemická encyklopédia
- (z lat. re prefix s významom spätné pôsobenie, a actio pôsobenie), premena niektorých na (počiatočné zlúčeniny) na iné (produkty stravy) s nemennosťou atómových jadier (na rozdiel od jadrových reakcií). Počiatočné zlúčeniny v R. x. niekedy nazývaný...... Chemická encyklopédia
- (z lat. fermentum starter) (enzýmy), bielkoviny, ktoré pôsobia ako katalyzátory v živých organizmoch. Základné funkcie F. na urýchlenie premeny látok vstupujúcich do tela a vznikajúcich pri látkovej premene (obnoviť bunkové štruktúry, zabezpečiť jej ... Chemická encyklopédia
- (z gréckeho pharmakon liek a kinetikos uvedenie do pohybu), študuje kinetiku. vzory procesov vyskytujúcich sa s lek. St vom v tele. Základné farmakokinetické procesy: vstrebávanie, distribúcia, metabolizmus a vylučovanie (odstraňovanie).... ... Chemická encyklopédia
Závislosť rýchlosti reakcie od koncentrácie enzýmu a koncentrácie substrátu (kinetika enzymatických reakcií) je znázornená v grafoch.
rozvrh 1 rozvrh 2
Pri enzymatickej reakcii ( F+S 2 ó 1 FS→ 3 F + P) Rozlišujú sa rýchlosti troch komponentov:
1- tvorba komplexu enzým-substrát FS,
2- spätný rozklad komplexu enzým-substrát,
3 – rozklad komplexu enzým-substrát za vzniku reakčných produktov. Rýchlosť každej z týchto reakcií sa riadi zákonom hromadnej akcie:
V 1 = K 1 [F]* [S]
V 2 = K 2 *
V momente rovnováhy sa reakčná rýchlosť tvorby FS rovná súčtu rýchlostí jeho rozpadu: V 1 = V 2 + V 3. Z troch štádií enzymatickej reakcie je najdôležitejší a najpomalší tretí, pretože je spojený s tvorbou reakčných produktov. Pomocou vyššie uvedeného vzorca nie je možné nájsť rýchlosť V 3, pretože komplex enzým-substrát je veľmi nestabilný, meranie jeho koncentrácie je náročné. V tejto súvislosti Michaelis-Menten zaviedol Km - Michaelisovu konštantu a transformoval rovnicu na meranie V 3 na novú rovnicu, v ktorej sú skutočne merateľné veličiny:
V 3 = K 3 * * [S] / Km + [S] alebo V 3 = V max * [S] / Km + [S]
– počiatočná koncentrácia enzýmu
Km – Michaelisova konštanta.
Fyzikálny význam km: Km = (K2 + K3) / K1. Ukazuje pomer rýchlostných konštánt rozkladu komplexu enzým-substrát a rýchlostnej konštanty jeho tvorby.
Michaelis-Mentenova rovnica je univerzálna. Ilustruje závislosť rýchlosti reakcie od [S]
1. Závislosť rýchlosti reakcie od koncentrácie substrátu. Táto závislosť sa prejavuje pri nízkych koncentráciách substrátu [S]
2. Závislosť rýchlosti od koncentrácie enzýmu sa objavuje pri vysokých koncentráciách substrátu. S≥ km. V tomto prípade možno Km zanedbať a rovnica sa stáva: V3 = K3* ((* [S]) / [S]) = K3* = V max. Pri vysokých koncentráciách substrátu je teda rýchlosť reakcie určená koncentráciou enzýmu a dosahuje svoju maximálnu hodnotu V 3 = K 3 = V max.(tretia časť grafu 2).
3. Umožňuje určiť číselnú hodnotu Km za predpokladu, že V 3 = V max /2. V tomto prípade má rovnica tvar:
V max /2 = ((V max *[S])/Km+[S], čo znamená, že Km=[S]
Km sa teda číselne rovná koncentrácii substrátu pri rýchlosti reakcie rovnajúcej sa polovici maxima. Km je veľmi dôležitá charakteristika enzýmu, meria sa v móloch (10 -2 – 10 -6 mol) a charakterizuje špecifickosť enzýmu: čím nižšia Km, tým vyššia špecifickosť enzýmu.
Grafická definícia Michaelisovej konštanty.
Je vhodnejšie použiť graf, ktorý predstavuje priamku. Takýto graf navrhol Lineweaver–Burk (graf dvojitých recipročných hodnôt), ktorý zodpovedá inverznej Michaelis–Mentenovej rovnici
Takmer všetky biochemické reakcie sú enzymatické. Enzýmy(biokatalyzátory) sú bielkovinové látky aktivované katiónmi kovov. Je známych asi 2000 rôznych enzýmov a asi 150 z nich bolo izolovaných, z ktorých niektoré sa používajú ako lieky. Trypsín a chymotrypsín sa používajú na liečbu bronchitídy a pneumónie; pepsín - na liečbu gastritídy; plazmín - na liečbu srdcového infarktu; Pankreatín – na liečbu pankreasu. Enzýmy sa líšia od konvenčných katalyzátorov: (a) vyššou katalytickou aktivitou; b) vysoká špecifickosť, t.j. selektívnosť pôsobenia.
Mechanizmus jednosubstrátovej enzymatickej reakcie možno znázorniť na nasledujúcom diagrame:
kde E je enzým,
S - substrát,
ES - komplex enzým-substrát,
P je reakčný produkt.
Charakteristickým znakom prvého stupňa enzymatickej reakcie je Michaelisova konštanta (K M). K M je prevrátená hodnota rovnovážnej konštanty:

Michaelisova konštanta (KM) charakterizuje stabilitu komplexu enzým-substrát (ES). Čím nižšia je Michaelisova konštanta (K M), tým je komplex stabilnejší.
Rýchlosť enzymatickej reakcie sa rovná rýchlosti jej rýchlostného limitu:
kde k 2 je rýchlostná konštanta, tzv počet otáčok alebo molekulárna aktivita enzýmu.
molekulárna enzýmová aktivita(k 2) sa rovná počtu molekúl substrátu, ktoré prechádzajú transformáciou pod vplyvom jednej molekuly enzýmu za 1 minútu pri 25 0 C. Táto konštanta nadobúda hodnoty v rozsahu: 1·10 4< k 2 < 6·10 6 мин‾ 1 .
Pre ureázu, ktorá urýchľuje hydrolýzu močoviny, k 2 = 1,85∙10 6 min‾ 1 ; pre adenozíntrifosfatázu, ktorá urýchľuje hydrolýzu ATP, k 2 = 6,24∙10 6 min‾ 1 ; pre katalázu, ktorá urýchľuje rozklad H 2 O 2, k 2 = 5∙10 6 min‾ 1.
Kinetická rovnica enzymatickej reakcie vo forme, v akej je uvedená vyššie, sa však prakticky nedá použiť z dôvodu nemožnosti experimentálne určiť koncentráciu komplexu enzým-substrát (). Vyjadrené inými veličinami, ktoré sa dajú ľahko určiť experimentálne, získame kinetickú rovnicu enzymatických reakcií, volal podľa Michaelisovej-Mentenovej rovnice (1913):
 ,
,
kde súčin k 2 [E] total je konštantná hodnota, ktorá je označená (maximálna rýchlosť).
Respektíve: 
Uvažujme o špeciálnych prípadoch Michaelis-Mentenovej rovnice.
1) Preto pri nízkej koncentrácii substrátu K M >> [S]

čo zodpovedá kinetickej rovnici reakcie prvého rádu.
2) Pri vysokej koncentrácii substrátu K m<< [S], поэтому
čo zodpovedá kinetickej rovnici reakcie nultého rádu.
Pri nízkej koncentrácii substrátu sa teda rýchlosť enzymatickej reakcie zvyšuje so zvyšujúcim sa obsahom substrátu v systéme a pri vysokej koncentrácii substrátu kinetická krivka dosiahne plató (rýchlosť reakcie nezávisí od koncentrácie substrátu) (obr. 30).

Obrázok 30. - Kinetická krivka enzymatickej reakcie
Ak [S] = K M, potom
čo umožňuje graficky určiť Michaelisovu konštantu K m (obr. 31).

Obrázok 31. - Grafická definícia Michaelisovej konštanty
Aktivitu enzýmov ovplyvňuje: (a) teplota, (b) kyslosť média, (c) prítomnosť inhibítorov. Vplyv teploty na rýchlosť enzymatickej reakcie je diskutovaný v kapitole 9.3.
Vplyv kyslosti média na rýchlosť enzymatickej reakcie je znázornený na obrázku 32. Maximálna aktivita enzýmu zodpovedá optimálnej hodnote pH (pH opt).

Obrázok 32. - Vplyv kyslosti roztoku na aktivitu enzýmu
Pre väčšinu enzýmov sa optimálne hodnoty pH zhodujú s fyziologickými hodnotami (7,3 - 7,4). Sú však enzýmy, ktorých normálne fungovanie vyžaduje silne kyslé (pepsín - 1,5 - 2,5) alebo dostatočne zásadité prostredie (argináza - 9,5 - 9,9).
Inhibítory enzýmov- sú to látky, ktoré obsadzujú časť aktívnych centier molekúl enzýmov, v dôsledku čoho klesá rýchlosť enzymatickej reakcie. Ako inhibítory pôsobia katióny ťažkých kovov, organické kyseliny a iné zlúčeniny.
Prednáška 11
Atómová štruktúra
Existujú dve definície pojmu „atóm“. Atom je najmenšia častica chemického prvku, ktorá si zachováva svoje chemické vlastnosti.
Atom je elektricky neutrálny mikrosystém pozostávajúci z kladne nabitého jadra a záporne nabitého elektrónového obalu.
Doktrína atómu prešla dlhou cestou vývoja. Medzi hlavné fázy vývoja atomizmu patria:
1) prírodná filozofická etapa - obdobie formovania koncepcie atómovej štruktúry hmoty, experimentom nepotvrdené (5. stor. pred Kr. - 16. stor. n. l.);
2) štádium vzniku hypotézy o atóme ako najmenšej častici chemického prvku (XVIII-XIX storočia);
3) štádium vytvárania fyzikálnych modelov, ktoré odrážajú zložitosť štruktúry atómu a umožňujú popísať jeho vlastnosti (začiatok 20. storočia)
4) moderné štádium atomizmu sa nazýva kvantová mechanika. Kvantová mechanika je oblasť fyziky, ktorá študuje pohyb elementárnych častíc.
PLÁNOVAŤ
11.1. Štruktúra jadra. Izotopy.
11.2. Kvantovo-mechanický model elektrónového obalu atómu.
11.3. Fyzikálno-chemické vlastnosti atómov.
Štruktúra jadra. Izotopy
Atómové jadro je kladne nabitá častica pozostávajúca z protónov, neutrónov a niektorých ďalších elementárnych častíc.
Všeobecne sa uznáva, že hlavnými elementárnymi časticami jadra sú protóny a neutróny. Protón (p) – je elementárna častica, ktorej relatívna atómová hmotnosť je 1 amu a jej relatívny náboj je + 1. Neutrón (n) – Ide o elementárnu časticu, ktorá nemá elektrický náboj a ktorej hmotnosť sa rovná hmotnosti protónu.
99,95 % hmotnosti atómu je sústredených v jadre. Medzi elementárnymi časticami existujú špeciálne jadrové rozťahovacie sily, ktoré výrazne prevyšujú sily elektrostatického odpudzovania.
Základnou charakteristikou atómu je poplatok jeho jadier, ktorý sa rovná počtu protónov a zhoduje sa s atómovým číslom prvku v periodickej tabuľke chemických prvkov. Súbor (typ) atómov s rovnakým jadrovým nábojom sa nazýva chemický prvok. Prvky s číslami od 1 do 92 sa nachádzajú v prírode.
Izotopy- sú to atómy toho istého chemického prvku obsahujúce rovnaký počet protónov a rôzny počet neutrónov v jadre.

kde hmotnostné číslo (A) je hmotnosť jadra, z je náboj jadra.
Každý chemický prvok je zmesou izotopov. Názov izotopov sa spravidla zhoduje s názvom chemického prvku. Pre izotopy vodíka však boli zavedené špeciálne názvy. Chemický prvok vodík je reprezentovaný tromi izotopmi:
Číslo p Číslo n
Protium N 10
Deutérium D11
Trícium T12
Izotopy chemického prvku môžu byť stabilné aj rádioaktívne. Rádioaktívne izotopy obsahujú jadrá, ktoré sa spontánne rozpadajú a uvoľňujú častice a energiu. Stabilita jadra je určená pomerom neutrónov a protónov.


Keď sa rádionuklidy dostanú do tela, narušia najdôležitejšie biochemické procesy, znížia imunitu a odsúdia telo na choroby. Organizmus sa pred účinkami žiarenia chráni selektívnym pohlcovaním prvkov z prostredia. Stabilné izotopy majú prednosť pred rádioaktívnymi izotopmi. Inými slovami, stabilné izotopy blokujú akumuláciu rádioaktívnych izotopov v živých organizmoch (tabuľka 8).
Kniha S. Shannona „Výživa v atómovom veku“ poskytuje nasledujúce údaje. Ak sa blokujúca dávka ~100 mg stabilného izotopu jódu užije najneskôr 2 hodiny po vstupe I-131 do tela, príjem rádiojódu v štítnej žľaze sa zníži o 90 %.
Rádioizotopy sa používajú v medicíne
na diagnostiku určitých chorôb,
· na liečbu všetkých foriem rakoviny,
· na patofyziologické štúdie.
Tabuľka 8 - Blokovací účinok stabilných izotopov
Enzýmová kinetika študuje rýchlosť reakcií katalyzovaných enzýmami v závislosti od rôznych podmienok (koncentrácia, teplota, pH atď.) ich interakcie so substrátom.
Enzýmy sú však bielkoviny, ktoré sú citlivé na vplyv rôznych vonkajších vplyvov. Preto pri štúdiu rýchlosti enzymatických reakcií berú do úvahy najmä koncentrácie reagujúcich látok a snažia sa minimalizovať vplyv teploty, pH prostredia, aktivátorov, inhibítorov a iných faktorov a vytvárať štandardné podmienky. Po prvé, je to hodnota pH prostredia, ktorá je optimálna pre daný enzým. Po druhé, tam, kde je to možné, sa odporúča udržiavať teplotu 25 °C. Po tretie, dosiahne sa úplné nasýtenie enzýmu substrátom. Tento bod je obzvlášť dôležitý, pretože pri nízkych koncentráciách substrátu sa na reakcii nezúčastňujú všetky molekuly enzýmu (obr. 6.5, A), čo znamená, že výsledok bude ďaleko od maximálneho možného. Najväčšia sila katalyzovanej reakcie, pričom ostatné veci sú rovnaké, sa dosiahne, ak sa každá molekula enzýmu zúčastní transformácie, t.j. pri vysokej koncentrácii komplexu enzým-substrát (obr. 6.5, V). Ak koncentrácia substrátu nezabezpečí úplné nasýtenie enzýmu (obr. 6.5, b), potom rýchlosť reakcie nedosiahne svoju maximálnu hodnotu.
Ryža. 65.
A - pri nízkej koncentrácii substrátu; 6 - s nedostatočnou koncentráciou substrátu; V - keď je enzým úplne nasýtený substrátom
Rýchlosť enzymatickej reakcie meraná za vyššie uvedených podmienok a úplné nasýtenie enzýmu substrátom sa nazýva maximálna rýchlosť enzymatickej reakcie (V).
Označuje sa rýchlosť enzymatickej reakcie, stanovená, keď enzým nie je úplne nasýtený substrátom v.
Enzýmovú katalýzu je možné zjednodušiť pomocou nasledujúceho diagramu:

kde F je enzým; S - substrát; FS - komplex enzým-substrát.
Každá fáza tohto procesu sa vyznačuje určitou rýchlosťou. Jednotkou merania rýchlosti enzymatickej reakcie je počet mólov substrátu prevedených za jednotku času(rovnaká ako rýchlosť normálnej reakcie).
Interakcia enzýmu so substrátom vedie k vytvoreniu komplexu enzým-substrát, ale tento proces je reverzibilný. Rýchlosti priamych a spätných reakcií závisia od koncentrácií reaktantov a sú opísané zodpovedajúcimi rovnicami:
V rovnovážnom stave platí rovnica (6.3), pretože rýchlosti priamych a spätných reakcií sú rovnaké.
Dosadením hodnôt rýchlosti doprednej (6.1) a spätnej (6.2) reakcie do rovnice (6.3) dostaneme rovnosť:
Rovnovážny stav je charakterizovaný primeraným rovnovážna konštanta Kp, rovná pomeru konštánt priamej a spätnej reakcie (6.5). Prevrátená hodnota rovnovážnej konštanty sa nazýva substrátová konštanta Ks, alebo disociačná konštanta komplexu enzým-substrát:

Z rovnice (6.6) je zrejmé, že substrátová konštanta pri vysokých koncentráciách komplexu enzým-substrát klesá, t.j. s veľkou stabilitou. Substrátová konštanta teda charakterizuje afinitu enzýmu a substrátu a pomer rýchlostných konštánt pre tvorbu a disociáciu komplexu enzým-substrát.
Fenomén nasýtenia enzýmov substrátom študovali Leonor Michaelis a Maud Mepten. Na základe matematického spracovania výsledkov odvodili rovnicu (6.7), ktorá dostala svoje názvy, z ktorej je zrejmé, že pri vysokej koncentrácii substrátu a nízkej hodnote substrátovej konštanty má rýchlosť enzymatickej reakcie tendenciu k max. . Táto rovnica je však obmedzená, pretože neberie do úvahy všetky parametre:
Komplex enzým-substrát môže počas reakcie prejsť transformáciou v rôznych smeroch:
- disociovať na materské látky;
- transformovať na produkt, z ktorého sa enzým oddelí nezmenený.
Preto, aby sme opísali celkové pôsobenie enzymatického procesu, koncept Michaelisove konštanty Kt, ktorý vyjadruje vzťah medzi rýchlostnými konštantami všetkých troch reakcií enzymatickej katalýzy (6.8). Ak sú oba členy delené konštantou reakčnej rýchlosti pre tvorbu komplexu enzým-substrát, dostaneme výraz (6.9):

Z rovnice (6.9) vyplýva dôležitý dôsledok: Michaelisova konštanta je vždy väčšia ako substrátová konštanta o množstvo k 2 /k v
Číselne K t rovná koncentrácii substrátu, pri ktorej je reakčná rýchlosť polovičná oproti maximálnej možnej rýchlosti a zodpovedá nasýteniu enzýmu substrátom, ako na obr. 6,5, b. Pretože v praxi nie je vždy možné dosiahnuť úplné nasýtenie enzýmu substrátom, je to presne tak K t používa sa na porovnávaciu charakterizáciu kinetických charakteristík enzýmov.
Rýchlosť enzymatickej reakcie, keď enzým nie je úplne nasýtený substrátom (6.10), závisí od koncentrácie komplexu enzým-substrát. Koeficient proporcionality je reakčná konštanta pre uvoľňovanie enzýmu a produktu, pretože to mení koncentráciu komplexu enzým-substrát:
Po transformáciách, berúc do úvahy vyššie uvedené závislosti, je rýchlosť enzymatickej reakcie, keď enzým nie je úplne nasýtený substrátom, opísaná rovnicou (6.11), t.j. závisí od koncentrácií enzýmu, substrátu a ich afinity K s:
Grafická závislosť rýchlosti enzymatickej reakcie od koncentrácie substrátu nie je lineárna. Ako je zrejmé z obr. 6.6, so zvyšujúcou sa koncentráciou substrátu sa pozoruje zvýšenie aktivity enzýmu. Keď sa však dosiahne maximálna saturácia enzýmu substrátom, rýchlosť enzymatickej reakcie sa stane maximálnou. Faktorom limitujúcim rýchlosť reakcie je preto tvorba komplexu enzým-substrát.
Prax ukázala, že koncentrácie substrátu sú spravidla vyjadrené v hodnotách oveľa menších ako jednota (106 -103 mol). Vo výpočtoch je dosť ťažké operovať s takýmito veličinami. Preto G. Lineweaver a D. Burke navrhli vyjadriť grafickú závislosť rýchlosti enzymatickej reakcie nie v priamych súradniciach, ale v inverzných. Vychádzali z predpokladu, že pre rovnaké množstvá sú rovnaké aj ich inverzné hodnoty:

Ryža. 6.6.
Po transformácii výrazu (6.13) získame výraz tzv Lineweaver-Burk rovnica (6.14):
Grafická závislosť Lineweaver-Burkovej rovnice je lineárna (obr. 6.7). Kinetické charakteristiky enzýmu sa určujú takto:
- segment odrezaný na zvislej osi sa rovná 1/V;
- segment odrezaný na osi x sa rovná -1 /Do t.

Ryža. 6.7.
Predpokladá sa, že metóda Lineweaver-Burk umožňuje určiť maximálnu rýchlosť reakcie presnejšie ako v priamych súradniciach. Z tohto grafu možno tiež získať cenné informácie týkajúce sa inhibície enzýmov.
Existujú aj iné spôsoby transformácie rovnice Michaelis-Menten. Grafické závislosti sa využívajú na štúdium vplyvu rôznych vonkajších vplyvov na enzymatický proces.
 Slabé skloňovanie podstatných mien
Slabé skloňovanie podstatných mien Informácie o prezidentoch našej krajiny
Informácie o prezidentoch našej krajiny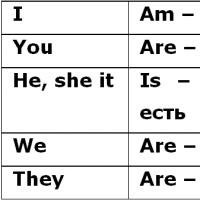 "Is", "are": použitie v angličtine Pravidlo tu bi v angličtine
"Is", "are": použitie v angličtine Pravidlo tu bi v angličtine Georgy Leonidovič Pyatakov: biografia Revolúcia a občianska vojna
Georgy Leonidovič Pyatakov: biografia Revolúcia a občianska vojna Musí prenajímateľ platiť daň z príjmu fyzických osôb z príjmu z prenájmu nehnuteľnosti?
Musí prenajímateľ platiť daň z príjmu fyzických osôb z príjmu z prenájmu nehnuteľnosti? Ako napísať vysvetlenie k žiadosti daňového inšpektorátu?
Ako napísať vysvetlenie k žiadosti daňového inšpektorátu? KBK penále DPH pre právnické osoby
KBK penále DPH pre právnické osoby