Výpočet množstva tepla potrebného na zahriatie telesa alebo ním uvoľneného pri ochladzovaní. Výpočet množstva tepla pri prenose tepla, merná tepelná kapacita látky
Ťažiskom nášho článku je množstvo tepla. Budeme uvažovať o koncepte vnútornej energie, ktorá sa transformuje, keď sa táto hodnota zmení. Ukážeme si aj niekoľko príkladov aplikácie výpočtov v ľudskej činnosti.
Teplo
S akýmkoľvek slovom v rodnom jazyku má každý človek svoje vlastné asociácie. Sú definované osobná skúsenosť a iracionálne pocity. Čo zvyčajne predstavuje slovo „teplo“? Mäkká deka, funkčná batéria ústredného kúrenia v zime, prvé slnečné svetlo na jar, mačka. Alebo matkin pohľad, utešujúce slovo od kamarátky, včasná pozornosť.
Fyzici pod tým myslia veľmi špecifický pojem. A veľmi dôležité, najmä v niektorých častiach tejto zložitej, no fascinujúcej vedy.

Termodynamika
Nemá cenu uvažovať o množstve tepla izolovane od najjednoduchších procesov, na ktorých je založený zákon zachovania energie – nič nebude jasné. Preto na úvod pripomíname našim čitateľom.
Termodynamika považuje akúkoľvek vec alebo predmet za kombináciu veľmi Vysoké číslo elementárne časti - atómy, ióny, molekuly. Jeho rovnice popisujú akúkoľvek zmenu v kolektívnom stave systému ako celku a ako časti celku pri zmene makro parametrov. Týmito poslednými sa rozumie teplota (označená ako T), tlak (P), koncentrácia zložiek (zvyčajne C).
Vnútorná energia
Vnútorná energia je pomerne komplikovaný pojem, ktorého význam by sme mali pochopiť skôr, ako budeme hovoriť o množstve tepla. Označuje energiu, ktorá sa mení so zvýšením alebo znížením hodnoty makro parametrov objektu a nezávisí od referenčného systému. Je súčasťou celkovej energie. Zhoduje sa s ním za podmienok, keď je ťažisko skúmanej veci v pokoji (to znamená, že neexistuje žiadna kinetická zložka).
Keď človek cíti, že sa nejaký predmet (povedzme bicykel) zahrial alebo ochladil, ukazuje to, že všetky molekuly a atómy, ktoré tvoria tento systém došlo k zmene vnútornej energie. Stálosť teploty však neznamená zachovanie tohto ukazovateľa.
Práca a teplo

Vnútorná energia akéhokoľvek termodynamického systému môže byť transformovaná dvoma spôsobmi:
- vykonávaním práce na ňom;
- pri výmene tepla s okolím.
Vzorec pre tento proces vyzerá takto:
dU=Q-A, kde U je vnútorná energia, Q je teplo, A je práca.
Nech sa čitateľ nenechá oklamať jednoduchosťou výrazu. Permutácia ukazuje, že Q=dU+A, ale zavedením entropie (S) sa vzorec dostane do tvaru dQ=dSxT.
Keďže v tomto prípade má rovnica formu diferenciálnej rovnice, prvý výraz vyžaduje to isté. Ďalej, v závislosti od síl pôsobiacich v skúmanom objekte a parametra, ktorý sa vypočítava, sa odvodí potrebný pomer.
Vezmime si kovovú guľu ako príklad termodynamického systému. Ak naň vyviniete tlak, hodíte ho, pustíte ho do hlbokej studne, znamená to, že na ňom budete pracovať. Navonok všetky tieto neškodné akcie nespôsobia loptičku žiadnu škodu, ale jej vnútorná energia sa zmení, aj keď veľmi mierne.
Druhým spôsobom je prenos tepla. Teraz prichádzame k hlavný cieľ tohto článku: popis toho, čo je to množstvo tepla. Ide o takú zmenu vnútornej energie termodynamického systému, ku ktorej dochádza pri prenose tepla (pozri vzorec vyššie). Meria sa v jouloch alebo kalóriách. Je zrejmé, že ak je lopta držaná nad zapaľovačom, na slnku alebo jednoducho v teplej ruke, zahreje sa. A potom zmenou teploty môžete zistiť množstvo tepla, ktoré mu bolo súčasne odovzdané.
Prečo je plyn najlepším príkladom zmeny vnútornej energie a prečo študenti kvôli nemu nemajú radi fyziku

Vyššie sme popísali zmeny termodynamických parametrov kovovej gule. Bez špeciálnych zariadení nie sú veľmi nápadné a čitateľ si môže povedať niečo o procesoch, ktoré sa vyskytujú s objektom. Ďalšia vec je, ak je systém plynový. Zatlačte naň - bude to viditeľné, zahrejte - tlak stúpne, spustite ho pod zem - a to sa dá ľahko opraviť. Preto sa v učebniciach ako vizuálny termodynamický systém najčastejšie berie plyn.
Ale, bohužiaľ, v moderné vzdelávanie skutočným experimentom sa nevenuje veľká pozornosť. vedec, ktorý píše Toolkit veľmi dobre rozumie čomu v otázke. Zdá sa mu, že na príklade molekúl plynu budú všetky termodynamické parametre dostatočne demonštrované. No pre študenta, ktorý tento svet ešte len objavuje, je nudné počúvať o ideálnej banke s teoretickým piestom. Ak by škola mala skutočné výskumné laboratóriá a vyhradené hodiny na prácu v nich, všetko by bolo inak. Zatiaľ sú, žiaľ, experimenty len na papieri. A s najväčšou pravdepodobnosťou to je presne to, čo spôsobuje, že ľudia považujú toto odvetvie fyziky za niečo čisto teoretické, ďaleko od života a zbytočné.

Preto sme sa rozhodli uviesť ako príklad už vyššie spomínaný bicykel. Osoba tlačí na pedále - pracuje na nich. Okrem prenosu krútiaceho momentu do celého mechanizmu (kvôli ktorému sa bicykel pohybuje v priestore) sa mení aj vnútorná energia materiálov, z ktorých sú páčky vyrobené. Cyklista stlačí kľučky, aby sa otočil, a znova vykoná prácu.
Vnútorná energia vonkajšieho povlaku (plastu alebo kovu) sa zvýši. Človek ide na čistinku pod ostrým slnkom - bicykel sa zahrieva, jeho množstvo tepla sa mení. Zastaví sa, aby si oddýchol v tieni starého dubu a systém sa ochladí, čím sa plytvajú kalórie alebo jouly. Zvyšuje rýchlosť – zvyšuje výmenu energie. Výpočet množstva tepla však vo všetkých týchto prípadoch ukáže veľmi malú, nepostrehnuteľnú hodnotu. Preto sa zdá, že prejavy termodynamickej fyziky v skutočný životč.
Aplikácia výpočtov na zmeny množstva tepla
Pravdepodobne si čitateľ povie, že je to všetko veľmi poučné, ale prečo nás v škole tak mučia tieto vzorce. A teraz si uvedieme príklady, v ktorých oblastiach ľudskej činnosti sú priam potrebné a ako sa to týka kohokoľvek v jeho bežnom živote.
Na začiatok sa rozhliadnite okolo seba a spočítajte: koľko kovových predmetov vás obklopuje? Pravdepodobne viac ako desať. Ale predtým, ako sa stane kancelárskou sponkou, vagónom, prsteňom alebo flash diskom, je roztavený akýkoľvek kov. Každý závod, ktorý spracováva povedzme železnú rudu, musí pochopiť, koľko paliva je potrebné na optimalizáciu nákladov. A pri tomto výpočte je potrebné poznať tepelnú kapacitu suroviny obsahujúcej kov a množstvo tepla, ktoré jej treba odovzdať, aby technologických procesov. Keďže energia uvoľnená jednotkou paliva sa počíta v jouloch alebo kalóriách, vzorce sú potrebné priamo.
Alebo iný príklad: väčšina supermarketov má oddelenie s mrazeným tovarom – rybami, mäsom, ovocím. Tam, kde sa suroviny zo živočíšneho mäsa alebo morských plodov menia na polotovary, musia vedieť, koľko elektriny spotrebujú chladiace a mraziace jednotky na tonu alebo jednotku hotového výrobku. Na to by ste si mali vypočítať, koľko tepla stratí kilogram jahôd alebo kalamárov pri ochladení o jeden stupeň Celzia. A nakoniec to ukáže, koľko elektriny minie mraznička určitej kapacity.
Lietadlá, lode, vlaky

Vyššie sme si ukázali príklady relatívne imobilných, statických objektov, ktoré sú informované, alebo naopak, určité množstvo tepla je im odobraté. Pre objekty pohybujúce sa v procese prevádzky v podmienkach neustále sa meniacej teploty sú výpočty množstva tepla dôležité z iného dôvodu.
Existuje niečo ako "únava kovu". Zahŕňa aj ultimátne prípustné zaťaženia pri určitej rýchlosti zmeny teploty. Predstavte si lietadlo vzlietajúce z vlhkých trópov do zamrznutej hornej atmosféry. Inžinieri musia tvrdo pracovať, aby sa nerozpadol kvôli prasklinám v kove, ktoré vznikajú pri zmene teploty. Hľadajú zliatinové zloženie, ktoré vydrží skutočné zaťaženie a bude mať veľkú mieru bezpečnosti. A aby ste nehľadali slepo v nádeji, že náhodou narazíte na požadované zloženie, musíte urobiť veľa výpočtov vrátane tých, ktoré zahŕňajú zmeny v množstve tepla.
730. Prečo sa voda používa na chladenie niektorých mechanizmov?
Voda má skvelú špecifické teplo, čo prispieva k dobrému odvodu tepla z mechanizmu.
731. V akom prípade treba vynaložiť viac energie: na zohriatie jedného litra vody o 1 °C alebo na zohriatie sto gramov vody o 1 °C?
Na zahriatie litra vody, pretože čím väčšia je hmotnosť, tým viac energie je potrebné minúť.
732. Kupronickel a strieborné vidličky rovnakej hmotnosti sa ponorili do horúcej vody. Prijímajú rovnaké množstvo tepla z vody?
Cupronickel vidlica dostane viac tepla, pretože špecifické teplo cupronickel viac ako striebro.
733. Kus olova a kus liatiny rovnakej hmotnosti bol trikrát udieraný perlíkom. Ktorá časť bola teplejšia?
Olovo sa zahreje viac, pretože jeho špecifická tepelná kapacita je menšia ako u liatiny a na ohrev olova je potrebných menej energie.
734. Jedna banka obsahuje vodu, druhá obsahuje petrolej rovnakej hmotnosti a teploty. Do každej banky sa hodila rovnako zahriata železná kocka. Čo sa viac zahreje vysoká teplota- voda alebo petrolej?
Petrolej.
735. Prečo sú teplotné výkyvy v zime a v lete v mestách na pobreží menej prudké ako v mestách vo vnútrozemí?
Voda sa ohrieva a ochladzuje pomalšie ako vzduch. V zime sa ochladzuje a presúva teplé vzduchové hmoty na pevninu, čím sa klíma na pobreží otepľuje.
736. Merná tepelná kapacita hliníka je 920 J/kg °C. Čo to znamená?
To znamená, že na zahriatie 1 kg hliníka o 1 °C je potrebných 920 J.
737. Hliníkové a medené tyče rovnakej hmotnosti 1 kg sa ochladia o 1 °C. Ako veľmi sa zmení vnútorná energia každého bloku? Ktorá lišta sa zmení viac a o koľko?
738. Aké množstvo tepla je potrebné na zohriatie kilogramového železného predliatku o 45 °C?
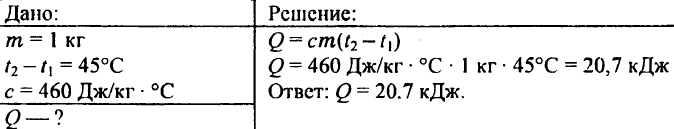
739. Koľko tepla je potrebné na zohriatie 0,25 kg vody z 30 °C na 50 °C?
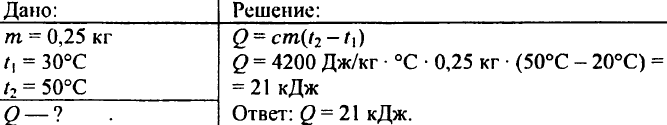
740. Ako sa zmení vnútorná energia dvoch litrov vody pri zahriatí o 5 °C?

741. Koľko tepla je potrebné na zohriatie 5 g vody z 20 °C na 30 °C?

742. Aké množstvo tepla je potrebné na zahriatie hliníkovej gule s hmotnosťou 0,03 kg na 72 °C?

743. Vypočítajte množstvo tepla potrebného na zohriatie 15 kg medi o 80 °C.

744. Vypočítajte množstvo tepla potrebného na zahriatie 5 kg medi z 10 °C na 200 °C.

745. Aké množstvo tepla je potrebné na zohriatie 0,2 kg vody z 15 °C na 20 °C?

746. Voda s hmotnosťou 0,3 kg sa ochladila o 20 °C. O koľko sa zníži vnútorná energia vody?

747. Koľko tepla je potrebné na zohriatie 0,4 kg vody s teplotou 20 °C na teplotu 30 °C?

748. Koľko tepla sa spotrebuje na ohrev 2,5 kg vody o 20 °C?
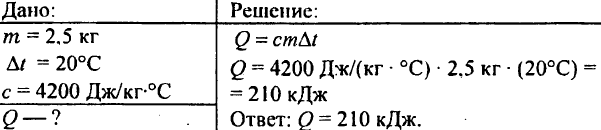
749. Koľko tepla sa uvoľnilo, keď sa 250 g vody ochladilo z 90 °C na 40 °C?
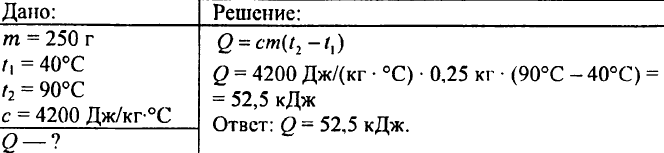
750. Aké množstvo tepla je potrebné na ohriatie 0,015 litra vody o 1 °C?

751. Vypočítajte množstvo tepla potrebného na ohrev jazierka s objemom 300 m3 o 10 °C?

752. Koľko tepla treba odovzdať 1 kg vody, aby sa jej teplota zvýšila z 30 °C na 40 °C?

753. Voda s objemom 10 litrov sa ochladila z teploty 100 °C na teplotu 40 °C. Koľko tepla sa v tomto prípade uvoľní?

754. Vypočítajte množstvo tepla potrebného na zohriatie 1 m3 piesku o 60 °C.

755. Objem vzduchu 60 m3, merná tepelná kapacita 1000 J/kg °C, hustota vzduchu 1,29 kg/m3. Koľko tepla je potrebné na zvýšenie teploty na 22 °C?
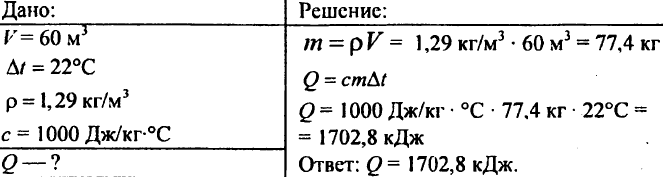
756. Voda sa ohriala o 10 °C, pričom sa spotrebovalo 4,20 103 J tepla. Určte množstvo vody.
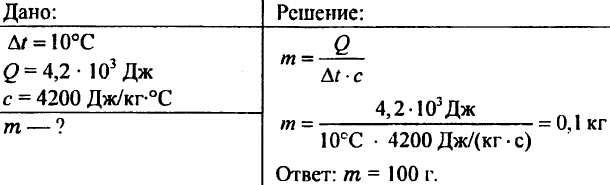
757. Voda s hmotnosťou 0,5 kg vykázala 20,95 kJ tepla. Aká bola teplota vody, ak bola počiatočná teplota vody 20°C?

758. Do medeného hrnca s hmotnosťou 2,5 kg sa naleje 8 kg vody s teplotou 10 °C. Koľko tepla je potrebné na privedenie vody do varu v hrnci?

759. Liter vody s teplotou 15 °C sa naleje do medenej naberačky s hmotnosťou 300 g Koľko tepla je potrebné na zohriatie vody v naberačke o 85 °C?

760. Kus vyhriatej žuly s hmotnosťou 3 kg sa vloží do vody. Žula odovzdá vode 12,6 kJ tepla, chladenie o 10 °C. Aká je špecifická tepelná kapacita kameňa?

761. Horúca voda s teplotou 50 °C sa pridala k 5 kg vody s teplotou 12 °C, čím sa získala zmes s teplotou 30 °C. Koľko vody sa pridalo?

762. Voda s teplotou 20 °C sa pridala do 3 litrov vody s teplotou 60 °C, čím sa získala voda s teplotou 40 °C. Koľko vody sa pridalo?

763. Aká bude teplota zmesi, ak sa 600 g vody 80 °C zmieša s 200 g vody 20 °C?

764. Liter vody s teplotou 90 °C sa nalial do vody s teplotou 10 °C a teplota vody dosiahla 60 °C. Koľko bolo studená voda?

765. Urči, koľko naliať do nádoby horúca voda, zahriaty na 60 ° C, ak nádoba už obsahuje 20 litrov studenej vody s teplotou 15 ° C; teplota zmesi by mala byť 40 °C.
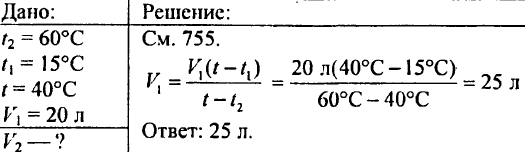
766. Určte, koľko tepla je potrebné na zohriatie 425 g vody o 20 °C.

767. O koľko stupňov sa ohreje 5 kg vody, ak voda prijme 167,2 kJ?

768. Koľko tepla je potrebné na zohriatie m gramov vody pri teplote t1 na teplotu t2?
769. 2 kg vody sa naleje do kalorimetra s teplotou 15 °C. Na akú teplotu sa zohreje voda v kalorimetri, ak sa do nej spustí mosadzné závažie s hmotnosťou 500 g zohriate na 100 °C? Špecifická tepelná kapacita mosadze je 0,37 kJ/(kg °C).

770. Sú tam kusy medi, cínu a hliníka rovnakého objemu. Ktorý z týchto kúskov má najväčšiu a ktorý najmenšiu tepelnú kapacitu?

771. Do kalorimetra sa nalialo 450 g vody, ktorej teplota je 20 °C. Keď sa do tejto vody ponorilo 200 g železných pilín zohriatych na 100 °C, teplota vody dosiahla 24 °C. Určte špecifickú tepelnú kapacitu pilín.

772. Medený kalorimeter s hmotnosťou 100 g pojme 738 g vody, ktorej teplota je 15 °C. Do tohto kalorimetra sa spustilo 200 g medi pri teplote 100 °C, potom teplota kalorimetra stúpla na 17 °C. Aká je špecifická tepelná kapacita medi?

773. Oceľová guľa s hmotnosťou 10 g sa vyberie z pece a spustí sa do vody s teplotou 10 °C. Teplota vody vystúpila na 25°C. Aká bola teplota gule v peci, ak hmotnosť vody bola 50 g? Merná tepelná kapacita ocele je 0,5 kJ/(kg °C).

777. 50 g vody s teplotou 19 °C sa naleje do vody s hmotnosťou 150 g s teplotou 35 °C. Aká je teplota zmesi?

778. Do liatinového kotla s hmotnosťou 2 kg sa pri teplote 10 °C naliala voda s hmotnosťou 5 kg s teplotou 90 °C. Aká bola teplota vody?

779. Oceľové dláto s hmotnosťou 2 kg sa zahrialo na teplotu 800 °C a potom sa spustilo do nádoby obsahujúcej 15 litrov vody s teplotou 10 °C. Na akú teplotu sa zohreje voda v nádobe?

(Indikácia. Na vyriešenie tohto problému je potrebné vytvoriť rovnicu, v ktorej sa požadovaná teplota vody v nádobe po spustení rezačky berie ako neznáma.)
780. Akú teplotu získa voda, ak zmiešate 0,02 kg vody s teplotou 15 °C, 0,03 kg vody s teplotou 25 °C a 0,01 kg vody s teplotou 60 °C?

781. Vykurovanie dobre vetranej triedy si vyžaduje množstvo tepla 4,19 MJ za hodinu. Voda vstupuje do vykurovacích radiátorov s teplotou 80 °C a vystupuje s teplotou 72 °C. Koľko vody treba dodať do radiátorov každú hodinu?

782. Olovo s hmotnosťou 0,1 kg pri teplote 100 °C bolo ponorené do hliníkového kalorimetra s hmotnosťou 0,04 kg s obsahom 0,24 kg vody s teplotou 15 °C. Potom bola v kalorimetri nastavená teplota 16 °C. Aká je špecifická tepelná kapacita olova?

Vnútornú energiu plynu vo valci môžete meniť nielen vykonávaním práce, ale aj zahrievaním plynu (obr. 43). Ak je piest pevný, objem plynu sa nezmení, ale zvýši sa teplota a tým aj vnútorná energia.
Proces prenosu energie z jedného tela do druhého bez vykonania práce sa nazýva prenos tepla alebo prenos tepla.
Energia odovzdaná telu v dôsledku prenosu tepla sa nazýva množstvo tepla. Množstvo tepla sa tiež nazýva energia, ktorú telo vydáva v procese prenosu tepla.
Molekulárny obraz prenosu tepla. Počas výmeny tepla na hranici medzi telesami pomaly sa pohybujúce molekuly studeného telesa interagujú s rýchlejšie sa pohybujúcimi molekulami horúceho telesa. V dôsledku toho sa kinetické energie molekúl vyrovnávajú a rýchlosti molekúl studeného telesa sa zvyšujú, zatiaľ čo rýchlosti horúceho telesa sa znižujú.
Počas výmeny tepla nedochádza k premene energie z jednej formy na druhú: časť vnútornej energie horúceho telesa sa prenáša na studené teleso.
Množstvo tepla a tepelná kapacita. Z kurzu fyziky triedy VII je známe, že na zahriatie telesa s hmotnosťou m z teploty t 1 na teplotu t 2 je potrebné informovať ho o množstve tepla.
Q \u003d cm (t 2 - t 1) \u003d cmΔt. (4,5)
Keď sa teleso ochladzuje, jeho večná teplota t 2 je nižšia ako počiatočná t 1 a množstvo tepla, ktoré teleso vydáva, je záporné.
Koeficient c vo vzorci (4.5) sa nazýva špecifické teplo. Špecifická tepelná kapacita je množstvo tepla, ktoré prijme alebo odovzdá 1 kg látky, keď sa jej teplota zmení o 1 K.
Špecifická tepelná kapacita sa vyjadruje v jouloch na kilogram krát kelvin. Rôzne telesá potrebujú rôzne množstvo energie na zvýšenie teploty o 1 K. Merná tepelná kapacita vody je teda 4190 J/(kg K) a medi 380 J/(kg K).
Merná tepelná kapacita závisí nielen od vlastností látky, ale aj od procesu, ktorým dochádza k prenosu tepla. Ak ohrievate plyn pri konštantnom tlaku, roztiahne sa a bude pracovať. Na zahriatie plynu o 1 °C pri konštantnom tlaku bude potrebné odovzdať viac tepla, ako ho zohriať pri konštantnom objeme.
tekuté a pevné telesá pri zahrievaní mierne expandujú a ich špecifické tepelné kapacity sa pri konštantnom objeme a konštantnom tlaku líšia len málo.
Špecifické teplo vyparovania. Aby sa kvapalina premenila na paru, musí sa jej odovzdať určité množstvo tepla. Teplota kvapaliny sa pri tejto premene nemení. Premena kvapaliny na paru pri konštantná teplota nevedie k zvýšeniu kinetickej energie molekúl, ale je sprevádzané zvýšením ich potenciálnej energie. Koniec koncov, priemerná vzdialenosť medzi molekulami plynu je mnohonásobne väčšia ako medzi molekulami kvapaliny. Okrem toho zväčšenie objemu pri prechode látky z kvapalného do plynného skupenstva vyžaduje prácu proti silám vonkajšieho tlaku.
Množstvo tepla potrebné na premenu 1 kg kvapaliny na paru pri konštantnej teplote sa nazýva špecifické teplo odparovanie. Táto hodnota sa označuje písmenom r a vyjadruje sa v jouloch na kilogram.
Špecifické teplo vyparovania vody je veľmi vysoké: 2,256 · 106 J/kg pri 100 °C. Pre ostatné kvapaliny (alkohol, éter, ortuť, petrolej atď.) je merné teplo vyparovania 3-10 krát menšie.
Na premenu kvapaliny s hmotnosťou m na paru je potrebné množstvo tepla, ktoré sa rovná:
Pri kondenzácii pary sa uvoľňuje rovnaké množstvo tepla
Q k = –rm. (4.7)
Špecifické teplo topenia. Keď sa kryštalické teleso topí, všetko teplo, ktoré sa mu dodáva, zvyšuje potenciálnu energiu molekúl. Kinetická energia molekúl sa nemení, pretože topenie prebieha pri konštantnej teplote.
Množstvo tepla λ (lambda) potrebné na premenu 1 kg kryštalická látka pri teplote topenia do kvapaliny s rovnakou teplotou sa nazýva špecifické teplo topenia.
Počas kryštalizácie 1 kg látky sa uvoľní presne rovnaké množstvo tepla. Špecifické teplo topenia ľadu je pomerne vysoké: 3,4 10 5 J/kg.
Aby sa roztopili kryštalické telo hmotnosť m, potrebujete množstvo tepla rovné:
Qpl \u003d λm. (4,8)
Množstvo tepla uvoľneného počas kryštalizácie tela sa rovná:
Q cr = - λm. (4.9)
1. Čo sa nazýva množstvo tepla? 2. Čo určuje mernú tepelnú kapacitu látok? 3. Čo sa nazýva špecifické teplo vyparovania? 4. Čo sa nazýva špecifické teplo topenia? 5. V akých prípadoch je množstvo odovzdaného tepla záporné?
>>Fyzika: Množstvo tepla
Vnútornú energiu plynu vo valci je možné meniť nielen vykonávaním práce, ale aj zahrievaním plynu.
Ak opravíte piest ( obr.13.5), potom sa objem plynu pri zahrievaní nemení a nevykonáva sa žiadna práca. Ale teplota plynu a tým aj jeho vnútorná energia sa zvyšuje.
Proces prenosu energie z jedného tela do druhého bez vykonania práce sa nazýva výmena tepla alebo prenos tepla.
Kvantitatívna miera zmeny vnútornej energie pri prenose tepla sa nazýva množstvo tepla. Množstvo tepla sa tiež nazýva energia, ktorú telo vydáva v procese prenosu tepla.
Molekulárny obraz prenosu tepla
Pri výmene tepla nedochádza k premene energie z jednej formy na druhú, časť vnútornej energie horúceho telesa sa prenáša na studené teleso.
Množstvo tepla a tepelná kapacita. To už viete ohrievať teleso hmotou m teplota t1 až do teploty t2 je potrebné do nej odovzdať množstvo tepla:
Keď sa teleso ochladí, jeho konečná teplota t2 je nižšia ako počiatočná teplota t1 a množstvo tepla, ktoré telo vydáva, je záporné.
Koeficient c vo vzorci (13.5) sa nazýva špecifické teplo látok. Špecifická tepelná kapacita je hodnota, ktorá sa číselne rovná množstvu tepla, ktoré látka s hmotnosťou 1 kg prijme alebo odovzdá, keď sa jej teplota zmení o 1 K.
Merná tepelná kapacita závisí nielen od vlastností látky, ale aj od procesu, ktorým dochádza k prenosu tepla. Ak ohrievate plyn pri konštantnom tlaku, roztiahne sa a bude pracovať. Na zahriatie plynu o 1°C pri konštantnom tlaku potrebuje odovzdať viac tepla, ako ho zohriať pri konštantnom objeme, kedy sa plyn bude iba ohrievať.
Kvapaliny a pevné látky pri zahrievaní mierne expandujú. Ich špecifické tepelné kapacity pri konštantnom objeme a konštantnom tlaku sa líšia len málo.
Špecifické teplo vyparovania. Na premenu kvapaliny na paru počas procesu varu je potrebné odovzdať jej určité množstvo tepla. Teplota kvapaliny sa pri varení nemení. Premena kvapaliny na paru pri konštantnej teplote nevedie k zvýšeniu kinetickej energie molekúl, ale je sprevádzaná zvýšením potenciálnej energie ich interakcie. Koniec koncov, priemerná vzdialenosť medzi molekulami plynu je oveľa väčšia ako medzi molekulami kvapaliny.
Nazýva sa hodnota, ktorá sa číselne rovná množstvu tepla potrebného na premenu 1 kg kvapaliny na paru pri konštantnej teplote špecifické teplo vyparovania. Táto hodnota je označená písmenom r a vyjadruje sa v jouloch na kilogram (J/kg).
Merné teplo vyparovania vody je veľmi vysoké: rH20\u003d 2,256 10 6 J / kg pri teplote 100 ° C. V iných kvapalinách, ako je napríklad alkohol, éter, ortuť, petrolej, je merné skupenské teplo vyparovania 3-10 krát menšie ako u vody.
Premeniť kvapalinu na hmotu m para vyžaduje množstvo tepla, ktoré sa rovná:
Keď para kondenzuje, uvoľňuje sa rovnaké množstvo tepla:
Hodnota, ktorá sa číselne rovná množstvu tepla potrebného na premenu kryštalickej látky s hmotnosťou 1 kg pri teplote topenia na kvapalinu, sa nazýva špecifické teplo topenia.
Pri kryštalizácii látky s hmotnosťou 1 kg sa uvoľní presne také množstvo tepla, aké sa absorbuje pri tavení.
Špecifické teplo topenia ľadu je pomerne vysoké: 3,34 10 5 J/kg. „Ak by ľad nemal vysoké teplo topenia,“ napísal R. Black už v 18. storočí, „potom by sa na jar celá masa ľadu musela roztopiť za niekoľko minút alebo sekúnd, pretože teplo sa neustále prenáša na ľad. zo vzduchu. Dôsledky toho by boli strašné; lebo aj za súčasnej situácie vznikajú veľké povodne a veľké prívaly vody z topenia veľkých más ľadu alebo snehu.“
Aby sa roztavilo kryštalické teleso s hmotou m, požadované množstvo tepla je:
Množstvo tepla uvoľneného počas kryštalizácie tela sa rovná:
Vnútorná energia telesa sa mení počas zahrievania a ochladzovania, počas odparovania a kondenzácie, počas topenia a kryštalizácie. Vo všetkých prípadoch sa určité množstvo tepla odovzdá alebo odoberie z tela.
???
1. Čo sa nazýva množstvo teplo?
2. Od čoho závisí merná tepelná kapacita látky?
3. Čo sa nazýva špecifické teplo vyparovania?
4. Čo sa nazýva špecifické teplo topenia?
5. V ktorých prípadoch je množstvo tepla kladné a v ktorých záporné?
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, 10. ročník fyziky
Obsah lekcie zhrnutie lekcie podpora rámcová lekcia prezentácia akceleračné metódy interaktívne technológie Prax úlohy a cvičenia samovyšetrenie workshopy, školenia, prípady, questy domáce úlohy diskusia otázky rétorické otázky od študentov Ilustrácie audio, videoklipy a multimédiá fotografie, obrázky, grafika, tabuľky, schémy humor, anekdoty, vtipy, komiksové podobenstvá, výroky, krížovky, citáty Doplnky abstraktyčlánky čipy pre zvedavých cheat sheets učebnice základný a doplnkový slovník pojmov iné Zdokonaľovanie učebníc a vyučovacích hodínoprava chýb v učebnici aktualizácia fragmentu v učebnici prvky inovácie v lekcii nahradenie zastaraných vedomostí novými Len pre učiteľov perfektné lekcie kalendárny plán na rok usmernenia diskusné programy Integrované lekcieAk máte opravy alebo návrhy k tejto lekcii,
Čo sa na sporáku rýchlejšie zohreje - rýchlovarná kanvica alebo vedro vody? Odpoveď je zrejmá – rýchlovarná kanvica. Potom je druhá otázka prečo?
Odpoveď nie je o nič menej zrejmá - pretože množstvo vody v kanvici je menšie. Výborne. A teraz si ten najskutočnejší fyzický zážitok môžete urobiť sami doma. Na to budete potrebovať dva rovnaké malé hrnce, rovnaké množstvo vody a zeleninový olej, napríklad pol litra a sporák. Dajte hrnce s olejom a vodou na rovnaký oheň. A teraz už len sledujte, čo sa rýchlejšie zahreje. Ak existuje teplomer na tekutiny, môžete ho použiť, ak nie, teplotu môžete len občas vyskúšať prstom, len pozor, aby ste sa nepopálili. V každom prípade čoskoro uvidíte, že sa olej výrazne zahreje. rýchlejšie ako voda. A ešte jedna otázka, ktorá sa dá realizovať aj formou zážitku. Čo vrie rýchlejšie – teplá voda alebo studená? Všetko je opäť zrejmé – prvý skončí ten teplý. Prečo všetky tieto zvláštne otázky a experimenty? Aby bolo možné definovať fyzikálne množstvo, nazývané „množstvo tepla“.
Množstvo tepla
Množstvo tepla je energia, ktorú telo stráca alebo získava pri prenose tepla. To je jasné už z názvu. Pri ochladzovaní telo stratí určité množstvo tepla a pri zahriatí ho absorbuje. A odpovede na naše otázky nám ukázali od čoho závisí množstvo tepla? Po prvé, čím viac telesnej hmotnosti, tým viac tepla treba vynaložiť na zmenu jeho teploty o jeden stupeň. Po druhé, množstvo tepla potrebného na zahriatie telesa závisí od látky, z ktorej sa skladá, teda od druhu látky. A po tretie, pre naše výpočty je dôležitý aj rozdiel telesnej teploty pred a po prestupe tepla. Na základe vyššie uvedeného môžeme určte množstvo tepla podľa vzorca:
Q=cm(t_2-t_1),
kde Q je množstvo tepla,
m - telesná hmotnosť,
(t_2-t_1) - rozdiel medzi počiatočným a konečným telesné teploty,
c - merná tepelná kapacita látky, zistí sa z príslušných tabuliek.
Pomocou tohto vzorca môžete vypočítať množstvo tepla, ktoré je potrebné na zahriatie akéhokoľvek telesa alebo ktoré toto teleso uvoľní, keď sa ochladí.
Množstvo tepla sa meria v jouloch (1 J), ako každá iná forma energie. Táto hodnota však bola zavedená nie tak dávno a ľudia začali merať množstvo tepla oveľa skôr. A použili jednotku, ktorá je v našej dobe široko používaná - kalória (1 cal). 1 kalória je množstvo tepla potrebné na zvýšenie teploty 1 gramu vody o 1 stupeň Celzia. Na základe týchto údajov si milovníci počítania kalórií v jedle, ktoré jedia, môžu pre zaujímavosť vypočítať, koľko litrov vody sa dá uvariť s energiou, ktorú počas dňa skonzumujú s jedlom.
 Ak sa manžel stal podráždeným
Ak sa manžel stal podráždeným Tablety na diabetes
Tablety na diabetes Tiež - je potrebná čiarka?
Tiež - je potrebná čiarka? Ako sa vyrábajú počítačové hry?
Ako sa vyrábajú počítačové hry? Výklad snov zlato, prečo snívať o zlate, vo sne zlato
Výklad snov zlato, prečo snívať o zlate, vo sne zlato Cystitída uretrálna laváž Ako dať podkľúčový katéter
Cystitída uretrálna laváž Ako dať podkľúčový katéter Horoskop prasa a tiger. Tiger - Prasa. Kompatibilita
Horoskop prasa a tiger. Tiger - Prasa. Kompatibilita