A test felmelegítéséhez szükséges vagy általa a hűtés során felszabaduló hőmennyiség kiszámítása. A hőátadás során keletkező hőmennyiség számítása, egy anyag fajlagos hőkapacitása
Cikkünk középpontjában a hőmennyiség áll. Megvizsgáljuk a belső energia fogalmát, amely átalakul, ha ez az érték megváltozik. Néhány példát mutatunk be a számítások emberi tevékenységben való alkalmazására is.
Hő
Az anyanyelv bármely szavával minden embernek megvan a maga asszociációja. Meg vannak határozva személyes tapasztalatés irracionális érzések. Mit jelent általában a "meleg" szó? Puha takaró, télen működő központi fűtés akkumulátor, tavasszal az első napfény, macska. Vagy anyai tekintet, egy barát vigasztaló szava, időszerű odafigyelés.
A fizikusok ez alatt egy nagyon specifikus kifejezést értenek. És nagyon fontos, különösen ennek az összetett, de lenyűgöző tudománynak egyes szakaszaiban.

Termodinamika
Nem érdemes a hőmennyiséget a legegyszerűbb folyamatoktól elkülönítve figyelembe venni, amelyeken az energiamegmaradás törvénye alapul - semmi sem lesz világos. Ezért először is emlékeztetjük olvasóinkat.
A termodinamika minden dolgot vagy tárgyat a nagyon kombinációjának tekint egy nagy szám elemi részek - atomok, ionok, molekulák. Egyenletei leírják a rendszer egészének kollektív állapotában és az egész részeként bekövetkező bármilyen változást a makroparaméterek megváltoztatásakor. Utóbbi alatt a hőmérsékletet (T-vel jelöljük), a nyomást (P), az összetevők koncentrációját (általában C-t) értjük.
Belső energia
A belső energia meglehetősen bonyolult kifejezés, amelynek jelentését meg kell érteni, mielőtt a hőmennyiségről beszélnénk. Azt az energiát jelöli, amely az objektum makróparamétereinek értékének növekedésével vagy csökkenésével változik, és nem függ a referenciarendszertől. A teljes energia része. Egybeesik vele olyan körülmények között, amikor a vizsgált dolog tömegközéppontja nyugalomban van (azaz nincs kinetikai komponens).
Ha egy személy úgy érzi, hogy valamilyen tárgy (például egy kerékpár) felmelegedett vagy kihűlt, ez azt mutatja, hogy az összes molekula és atom, amelyet alkotó ezt a rendszert változást tapasztalt a belső energiájában. A hőmérséklet állandósága azonban nem jelenti ennek a mutatónak a megőrzését.
Munka és melegség

Bármely termodinamikai rendszer belső energiája kétféleképpen alakítható át:
- azáltal, hogy munkát végez rajta;
- a környezettel való hőcsere során.
A folyamat képlete így néz ki:
dU=Q-A, ahol U belső energia, Q hő, A munka.
Ne tévessze meg az olvasót a kifejezés egyszerűsége. A permutáció azt mutatja, hogy Q=dU+A, de az entrópia (S) bevezetése a képletet dQ=dSxT alakba hozza.
Mivel ebben az esetben az egyenlet differenciálegyenlet alakját veszi fel, az első kifejezés ugyanezt követeli meg. Továbbá a vizsgált objektumban ható erőktől és a számítás alatt álló paramétertől függően a szükséges arányt levezetjük.
Vegyünk egy fémgolyót a termodinamikai rendszer példájaként. Ha nyomást gyakorolsz rá, feldobod, mély kútba dobod, akkor ez azt jelenti, hogy dolgozol rajta. Külsőleg mindezek az ártalmatlan cselekedetek nem okoznak kárt a labdában, de a belső energiája megváltozik, bár nagyon enyhén.
A második módszer a hőátadás. Most elérkeztünk fő cél a cikkből: a hőmennyiség leírása. Ez egy termodinamikai rendszer belső energiájának olyan változása, amely a hőátadás során következik be (lásd a fenti képletet). Joule-ban vagy kalóriában mérik. Nyilvánvaló, hogy ha a labdát egy öngyújtó fölé tartjuk, a napon, vagy egyszerűen csak meleg kézben tartjuk, akkor felmelegszik. És akkor a hőmérséklet változtatásával meg lehet találni azt a hőmennyiséget, amelyet egyidejűleg közöltek vele.
Miért a gáz a legjobb példa a belső energia változására, és miért nem szeretik a diákok emiatt a fizikát

Fentebb egy fémgolyó termodinamikai paramétereinek változásait írtuk le. Speciális eszközök nélkül nem nagyon észrevehetőek, az olvasónak marad szó a tárggyal végbemenő folyamatokról. Egy másik dolog, ha a rendszer gáz. Nyomd rá - látható lesz, melegítsd fel - emelkedik a nyomás, engedd le a föld alá - és ez könnyen javítható. Ezért a tankönyvekben a gázt leggyakrabban vizuális termodinamikai rendszernek tekintik.
De sajnos bent modern oktatás nem sok figyelmet fordítanak a valódi kísérletekre. tudós, aki ír Eszközkészlet nagyon jól érti, mit kérdéses. Úgy tűnik számára, hogy a gázmolekulák példájával minden termodinamikai paraméter megfelelően demonstrálható lesz. De egy diák számára, aki csak felfedezi ezt a világot, unalmas egy elméleti dugattyús, ideális lombikról hallani. Ha az iskolának valódi kutatólaboratóriumai lennének, és azokban lekötött órákat dolgoznának, minden más lenne. Egyelőre sajnos csak papíron vannak a kísérletek. És a legvalószínűbb, hogy ez az oka annak, hogy az emberek a fizika eme ágát pusztán elméletinek, az élettől távol állónak és szükségtelennek tekintik.

Ezért úgy döntöttünk, hogy a fentebb már említett kerékpárt hozzuk példaként. Az ember megnyomja a pedálokat – dolgozik rajtuk. Amellett, hogy a nyomatékot kommunikálja a teljes mechanizmussal (aminek köszönhetően a kerékpár a térben mozog), megváltozik azoknak az anyagoknak a belső energiája, amelyekből a karok készülnek. A kerékpáros megnyomja a fogantyúkat, hogy forduljon, és ismét elvégzi a munkát.
A külső bevonat (műanyag vagy fém) belső energiája megnő. Az ember egy tisztásra megy a ragyogó nap alatt - a kerékpár felmelegszik, hőmennyisége megváltozik. Megáll pihenni egy öreg tölgyfa árnyékában, és a rendszer lehűl, kalóriát vagy joule-t pazarolva. Növeli a sebességet – fokozza az energiacserét. A hőmennyiség számítása azonban mindezen esetekben nagyon kicsi, észrevehetetlen értéket mutat. Ezért úgy tűnik, hogy a termodinamikai fizika megnyilvánulásai in való élet nem.
Számítások alkalmazása a hőmennyiség változására
Valószínűleg az olvasó azt fogja mondani, hogy mindez nagyon informatív, de miért kínoznak minket ennyire az iskolában ezekkel a képletekkel. És most példákat adunk, hogy az emberi tevékenység mely területein van rájuk közvetlenül szükség, és hogyan vonatkozik ez bárkire a mindennapi életében.
Először is nézz körül, és számold meg: hány fémtárgy vesz körül? Valószínűleg több mint tíz. Mielőtt azonban gemkapocs, kocsi, gyűrű vagy pendrive válna belőle, minden fém megolvasztódik. Minden üzemnek, amely mondjuk vasércet dolgoz fel, meg kell értenie, hogy mennyi tüzelőanyagra van szükség a költségek optimalizálása érdekében. Ennek kiszámításakor pedig ismerni kell a fémtartalmú alapanyag hőkapacitását és azt a hőmennyiséget, amit át kell adni ahhoz, hogy minden technológiai folyamatok. Mivel az egységnyi üzemanyag által felszabaduló energiát joule-ban vagy kalóriában számítják ki, a képletekre közvetlenül szükség van.
Vagy egy másik példa: a legtöbb szupermarketnek van egy részlege fagyasztott árukkal – hal, hús, gyümölcs. Ha az állati húsból vagy tenger gyümölcseiből származó nyersanyagokat félkész termékekké alakítják át, tudniuk kell, hogy a hűtő- és fagyasztóegységek mennyi villamos energiát használnak fel tonnánként vagy késztermékegységenként. Ehhez ki kell számítani, hogy egy kilogramm eper vagy tintahal mennyi hőt veszít egy Celsius-fokkal lehűtve. És a végén ez megmutatja, hogy egy bizonyos kapacitású fagyasztó mennyi áramot fog elkölteni.
Repülőgépek, hajók, vonatok

Fentebb példákat mutattunk be viszonylag mozdulatlan, statikus tárgyakra, amelyek tájékozódnak, vagy éppen ellenkezőleg, bizonyos mennyiségű hőt vonnak el tőlük. A folyamatosan változó hőmérsékleti körülmények között működés közben mozgó objektumok esetében a hőmennyiség számítása más okból is fontos.
Van olyan, hogy "fémfáradtság". Ez magában foglalja a végsőt is megengedett terhelések egy bizonyos hőmérséklet-változási sebesség mellett. Képzeljen el egy repülőgépet, amely a nedves trópusokról felszáll a fagyos felső légkörbe. A mérnököknek keményen kell dolgozniuk, hogy ne essen szét a hőmérséklet változásakor megjelenő fémrepedések miatt. Olyan ötvözet összetételt keresnek, ami kibírja valódi terhelésekés nagy biztonsági rés lesz. És annak érdekében, hogy ne keressen vakon, abban a reményben, hogy véletlenül belebotlik a kívánt összetételbe, sok számítást kell végeznie, beleértve azokat is, amelyek a hőmennyiség változásait is tartalmazzák.
730. Miért használnak vizet egyes mechanizmusok hűtésére?
A víz nagyszerű fajlagos hő, ami hozzájárul a jó hőelvezetéshez a mechanizmusból.
731. Milyen esetben kell több energiát fordítani: egy liter víz 1 °C-os felmelegítésére vagy száz gramm víz 1 °C-os melegítésére?
Egy liter víz felmelegítéséhez, mivel minél nagyobb a tömeg, annál több energiát kell elkölteni.
732. Azonos tömegű cupronickel- és ezüstvillákat forró vízbe mártottak. A vízből ugyanannyi hőt kapnak?
Cupronickel villa több hőt kap, mert fajlagos hő réz-nikkel több mint ezüst.
733. Egy azonos tömegű ólomdarabot és egy öntöttvas darabot háromszor ütöttek kalapáccsal. Melyik része lett melegebb?
Az ólom jobban felmelegszik, mert fajlagos hőkapacitása kisebb, mint az öntöttvasé, és kevesebb energia szükséges az ólom felmelegítéséhez.
734. Az egyik lombikban víz, a másikban azonos tömegű és hőmérsékletű kerozin. Mindegyik lombikba egy ugyanolyan melegített vaskockát dobtak. Mi melegszik fel jobban magas hőmérsékletű- víz vagy kerozin?
Kerozin.
735. Miért kevésbé élesek a hőmérséklet-ingadozások télen és nyáron a tengerparti városokban, mint a szárazföldi városokban?
A víz lassabban melegszik fel és hűl le, mint a levegő. Télen lehűl és meleg légtömegeket mozgat a szárazföldön, így melegebbé válik a tengerpart éghajlata.
736. Az alumínium fajlagos hőkapacitása 920 J/kg °C. Mit is jelent ez?
Ez azt jelenti, hogy 1 kg alumínium 1 °C-kal történő felmelegítéséhez 920 J szükséges.
737. Az 1 kg azonos tömegű alumínium- és rézrudakat 1 °C-kal lehűtik. Mennyire változik az egyes blokkok belső energiája? Melyik sáv változik jobban és mennyivel?
738. Mennyi hő szükséges egy kilogramm vastömb 45 °C-os felmelegítéséhez?
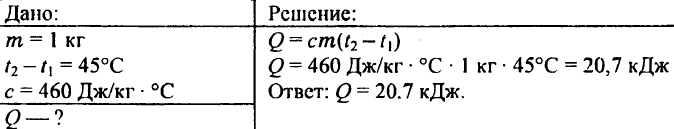
739. Mennyi hő szükséges 0,25 kg víz 30°C-ról 50°C-ra való felmelegítéséhez?
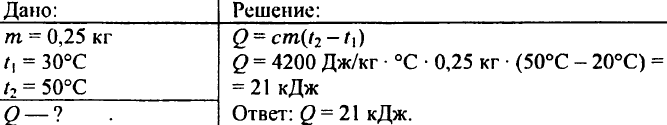
740. Hogyan változik két liter víz belső energiája 5 °C-os felmelegítés esetén?

741. Mennyi hő szükséges 5 g víz 20 °C-ról 30 °C-ra történő felmelegítéséhez?

742. Mekkora hő szükséges egy 0,03 kg tömegű alumíniumgolyó 72 °C-os felmelegítéséhez?

743. Számítsa ki 15 kg réz 80 °C-os felmelegítéséhez szükséges hőmennyiséget!

744. Számítsa ki 5 kg réz 10 °C-ról 200 °C-ra való felmelegítéséhez szükséges hőmennyiséget!

745. Mekkora hőmennyiség szükséges 0,2 kg víz 15 °C-ról 20 °C-ra való felmelegítéséhez?

746. A 0,3 kg tömegű víz 20 °C-kal lehűlt. Mennyivel csökken a víz belső energiája?

747. Mennyi hő szükséges 0,4 kg 20 °C-os víz 30 °C-os hőmérsékletű felmelegítéséhez?

748. Mennyi hőt fordítanak 2,5 kg víz 20 °C-os felmelegítésére?
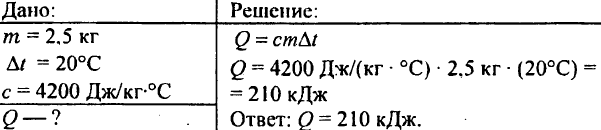
749. Mennyi hő szabadul fel, amikor 250 g víz 90 °C-ról 40 °C-ra hűlt le?
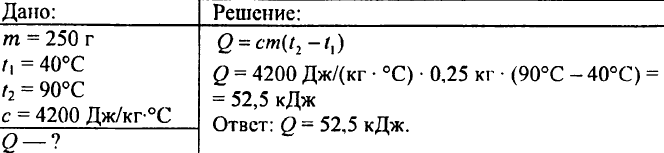
750. Mekkora hőmennyiség szükséges 0,015 liter víz 1 °C-os felmelegítéséhez?

751. Számítsa ki egy 300 m3 térfogatú tó 10 °C-os felfűtéséhez szükséges hőmennyiséget?

752. Mennyi hőt kell leadni 1 kg víznek, hogy a hőmérséklete 30°C-ról 40°C-ra emelkedjen?

753. A 10 literes víz 100 °C-os hőmérsékletről 40 °C-ra hűlt le. Mennyi hő szabadul fel ebben az esetben?

754. Számítsa ki 1 m3 homok 60 °C-os felmelegítéséhez szükséges hőmennyiséget!

755. Levegőtérfogat 60 m3, fajhőteljesítmény 1000 J/kg °C, levegő sűrűsége 1,29 kg/m3. Mennyi hő szükséges a 22°C-ra emeléséhez?
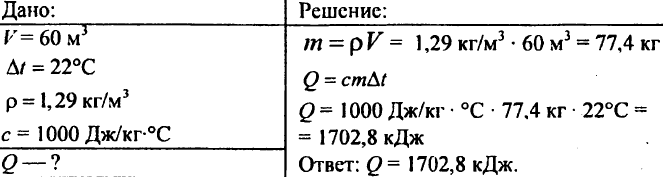
756. A vizet 10 °C-ra melegítettük, 4,20 103 J hőt költve el. Határozza meg a víz mennyiségét.
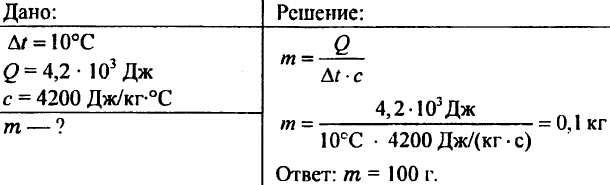
757. A 0,5 kg tömegű víz 20,95 kJ hőt jelentett. Milyen hőmérsékletű volt a víz, ha a víz kezdeti hőmérséklete 20°C?

758. 8 kg 10 °C-os vizet öntünk egy 2,5 kg tömegű rézfazékba. Mennyi hő szükséges ahhoz, hogy a vizet egy serpenyőben felforraljuk?

759. Egy 300 g súlyú réz üstbe egy liter 15 °C-os vizet öntünk, mekkora hő szükséges ahhoz, hogy az üstben lévő vizet 85 °C-ra felmelegítsük?

760. Egy 3 kg tömegű hevített gránitdarabot vízbe teszünk. A gránit 12,6 kJ hőt ad át a víznek, 10 °C-kal lehűtve. Mekkora a kő fajlagos hőkapacitása?

761. 50 °C-os forró vizet adunk 5 kg 12 °C-os vízhez, így 30 °C-os keveréket kapunk. Mennyi vizet adtak hozzá?

762. 20 °C-os vizet adunk 3 liter 60 °C-os vízhez, így 40 °C-os vizet kapunk. Mennyi vizet adtak hozzá?

763. Milyen hőmérsékletű lesz a keverék, ha 600 g 80 °C-os vizet összekeverünk 200 g 20 °C-os vízzel?

764. Egy liter 90°C-os vizet öntöttünk 10°C-os vízbe, és a víz hőmérséklete 60°C lett. Mennyi volt hideg víz?

765. Határozza meg, mennyit kell önteni egy edénybe! forró víz 60 °C-ra melegítve, ha az edényben már van 20 liter 15 °C-os hideg víz; a keverék hőmérséklete 40 °C legyen.
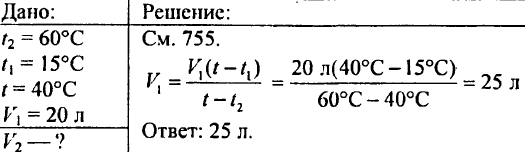
766. Határozza meg, mennyi hő szükséges 425 g víz 20 °C-os felmelegítéséhez!

767. Hány fokot melegszik fel 5 kg víz, ha a víz 167,2 kJ-t kap?

768. Mennyi hő szükséges m gramm t1 hőmérsékletű víz t2 hőmérsékletre való felmelegítéséhez?
769. 2 kg vizet öntünk egy kaloriméterbe 15 °C hőmérsékleten. Milyen hőmérsékletre melegszik fel a kaloriméter vize, ha 500 g-os, 100 °C-ra melegített sárgarézsúlyt engedünk bele? A sárgaréz fajlagos hőkapacitása 0,37 kJ/(kg °C).

770. Egyforma térfogatú réz-, ón- és alumíniumdarabok vannak. Ezen darabok közül melyik a legnagyobb és melyik a legkisebb hőkapacitású?

771. A kaloriméterbe 450 g vizet öntöttünk, melynek hőmérséklete 20 °C. Amikor 200 g 100°C-ra melegített vasreszeléket mártottak ebbe a vízbe, a víz hőmérséklete 24°C lett. Határozza meg a fűrészpor fajlagos hőkapacitását!

772. Egy 100 g tömegű rézkaloriméter 738 g vizet tartalmaz, melynek hőmérséklete 15 °C. Ebbe a kaloriméterbe 200 g rezet engedtünk 100 °C hőmérsékleten, majd a kaloriméter hőmérséklete 17 °C-ra emelkedett. Mekkora a réz fajlagos hőkapacitása?

773. Egy 10 g tömegű acélgolyót kiveszünk a kemencéből, és 10 °C-os vízbe engedjük. A víz hőmérséklete 25°C-ra emelkedett. Milyen hőmérsékletű volt a golyó a sütőben, ha a víz tömege 50 g? Az acél fajlagos hőkapacitása 0,5 kJ/(kg °C).

777. 50 g 19 °C-os vizet öntünk 150 g tömegű, 35 °C-os vízbe. Milyen hőmérsékletű a keverék?

778. 5 kg tömegű, 90 °C-os vizet öntöttünk egy 2 kg tömegű öntöttvas üstbe 10 °C hőmérsékleten. Milyen hőmérsékletű volt a víz?

779. Egy 2 kg tömegű acélvésőt 800 °C-ra melegítettünk, majd 15 liter vizet tartalmazó edénybe eresztettünk 10 °C hőmérsékleten. Milyen hőmérsékletre melegszik fel a víz az edényben?

(Jelzés. A probléma megoldásához létre kell hozni egy egyenletet, amelyben az edényben lévő víz kívánt hőmérsékletét a vágó leengedése után ismeretlennek vesszük.)
780. Milyen hőmérsékletű lesz a víz, ha 0,02 kg 15 °C-os, 0,03 kg 25 °C-os és 0,01 kg 60 °C-os vizet keverünk össze?

781. Jól szellőző osztály fűtéséhez óránként 4,19 MJ hőmennyiség szükséges. A víz 80°C-on lép be a fűtőtestekbe és 72°C-on távozik. Mennyi vizet kell adagolni óránként a radiátorokhoz?

782. 0,1 kg tömegű ólmot 100 °C hőmérsékleten 0,04 kg tömegű alumínium kaloriméterbe merítettünk, amely 0,24 kg vizet tartalmazott 15 °C hőmérsékleten. Ezt követően a kaloriméterben 16 °C hőmérsékletet állítottunk be. Mekkora az ólom fajlagos hőkapacitása?

A palackban lévő gáz belső energiáját nem csak munkavégzéssel, hanem a gáz melegítésével is megváltoztathatja (43. ábra). Ha a dugattyú rögzítve van, akkor a gáz térfogata nem változik, de a hőmérséklet, és ezáltal a belső energia nő.
Azt a folyamatot, amelyben az energia egyik testről a másikra munka nélkül kerül átadásra, hőátadásnak vagy hőátadásnak nevezzük.
A hőátadás eredményeként a szervezetbe átadott energiát hőmennyiségnek nevezzük. A hőmennyiséget energiának is nevezik, amelyet a test a hőátadás során lead.
A hőátadás molekuláris képe. A testek közötti határvonalon zajló hőcsere során a hideg test lassan mozgó molekulái kölcsönhatásba lépnek a forró test gyorsabban mozgó molekuláival. Ennek eredményeként a molekulák kinetikai energiái kiegyenlítődnek, és a hideg test molekuláinak sebessége nő, míg a forró testé csökken.
A hőcsere során nem történik energia átalakulás egyik formából a másikba: a forró test belső energiájának egy része átkerül a hideg testbe.
A hőmennyiség és a hőkapacitás. A VII. osztályú fizika kurzusból ismert, hogy egy m tömegű test t 1 hőmérsékletről t 2 hőmérsékletre történő felmelegítéséhez szükséges a hőmennyiségről tájékoztatni.
Q \u003d cm (t 2 - t 1) \u003d cmΔt. (4.5)
Amikor egy test lehűl, örök hőmérséklete t 2 kisebb, mint a kezdeti t 1, és a test által leadott hőmennyiség negatív.
A (4.5) képletben szereplő c együtthatót nevezzük fajlagos hő. A fajlagos hőkapacitás az a hőmennyiség, amelyet 1 kg anyag kap vagy ad le, ha hőmérséklete 1 K-vel változik.
A fajlagos hőkapacitást joule per kilogramm-szor kelvinben fejezzük ki. Különböző testek eltérő mennyiségű energiát igényelnek a hőmérséklet 1 K-nel történő emeléséhez. Így a víz fajlagos hőkapacitása 4190 J/(kg K), a rézé 380 J/(kg K).
A fajlagos hőkapacitás nemcsak az anyag tulajdonságaitól függ, hanem attól is, hogy milyen folyamatban megy végbe a hőátadás. Ha egy gázt állandó nyomáson melegít, az kitágul és működik. Ahhoz, hogy egy gázt állandó nyomáson 1 °C-kal felmelegítsen, több hőt kell átadnia, mint állandó térfogaton.
folyékony és szilárd testek hevítés hatására enyhén kitágul, és fajlagos hőkapacitásuk állandó térfogaton és állandó nyomáson alig tér el.
Fajlagos párolgási hő. A folyadék gőzzé alakításához bizonyos mennyiségű hőt kell átadni rá. A folyadék hőmérséklete az átalakulás során nem változik. A folyadék gőzzé alakulása at állandó hőmérséklet nem vezet a molekulák kinetikus energiájának növekedéséhez, hanem potenciális energiájuk növekedésével jár együtt. Végül is a gázmolekulák közötti átlagos távolság sokszorosa a folyadékmolekulák közötti távolságnak. Ezenkívül az anyag folyadékból gáz halmazállapotúvá történő átmenete során a térfogatnövekedés a külső nyomás erőivel szembeni munkát igényel.
Azt a hőmennyiséget, amely 1 kg folyadék gőzzé alakításához szükséges állandó hőmérsékleten, ún fajlagos hő párologtatás. Ezt az értéket r betűvel jelöljük, és joule per kilogrammban fejezzük ki.
A víz fajpárolgási hője nagyon magas: 2,256 · 10 6 J/kg 100°C-on. Más folyadékoknál (alkohol, éter, higany, kerozin stb.) a párolgási fajhő 3-10-szer kisebb.
Az m tömegű folyadék gőzzé alakításához annyi hőre van szükség, mint:
A gőz lecsapódásakor ugyanannyi hő szabadul fel
Q k = –rm. (4.7)
Fajlagos olvadási hő. Amikor egy kristályos test megolvad, a hozzá szállított összes hő a molekulák potenciális energiájának növelésére megy el. A molekulák kinetikus energiája nem változik, mivel az olvadás állandó hőmérsékleten megy végbe.
Az 1 kg átalakításához szükséges λ (lambda) hőmennyiség kristályos anyag olvadáspontján azonos hőmérsékletű folyadékká fajlagos olvadási hőnek nevezzük.
1 kg anyag kristályosodása során pontosan ugyanannyi hő szabadul fel. A jégolvadás fajhője meglehetősen magas: 3,4 10 5 J/kg.
Hogy megolvadjon kristályos test tömeg m, akkor a hőmennyiségre van szükség:
Qpl \u003d λm. (4.8)
A test kristályosodása során felszabaduló hőmennyiség egyenlő:
Q cr = - λm. (4.9)
1. Mit nevezünk hőmennyiségnek? 2. Mi határozza meg az anyagok fajlagos hőkapacitását? 3. Mit nevezünk párolgási fajhőnek? 4. Mit nevezünk fajlagos olvadási hőnek? 5. Milyen esetekben negatív az átadott hő mennyisége?
>>Fizika: Hőmennyiség
A palackban lévő gáz belső energiáját nemcsak munkavégzéssel, hanem a gáz felmelegítésével is lehet változtatni.
Ha rögzíti a dugattyút ( ábra.13.5), akkor a gáz térfogata nem változik melegítéskor és nem történik munka. De a gáz hőmérséklete, és ezáltal belső energiája is nő.
Az energia egyik testből a másikba munkavégzés nélkül történő átvitelének folyamatát nevezzük hőcsere vagy hőátadás.
A belső energia hőátadás során bekövetkező változásának mennyiségi mértékét ún hőmennyiség. A hőmennyiséget energiának is nevezik, amelyet a test a hőátadás során lead.
A hőátadás molekuláris képe
A hőcsere során nem történik energia átalakulás egyik formából a másikba, a forró test belső energiájának egy része átkerül a hideg testbe.
A hőmennyiség és a hőkapacitás. Azt már tudod, hogy egy testet tömeggel kell felmelegíteni m hőfok t1 hőmérsékletig t2át kell adni a hőmennyiséget:
Amikor a test lehűl, a végső hőmérséklete t2 alacsonyabb, mint a kezdeti hőmérséklet t1és a test által leadott hőmennyiség negatív.
Együttható c képletben (13.5) nevezzük fajlagos hő anyagokat. A fajlagos hőkapacitás számszerűen megegyezik azzal a hőmennyiséggel, amelyet egy 1 kg tömegű anyag kap vagy ad le, ha hőmérséklete 1 K-vel változik.
A fajlagos hőkapacitás nemcsak az anyag tulajdonságaitól függ, hanem attól is, hogy milyen folyamatban megy végbe a hőátadás. Ha egy gázt állandó nyomáson melegít, az kitágul és működik. Ahhoz, hogy egy gázt állandó nyomáson 1°C-kal felmelegítsen, több hőt kell átadnia, mint állandó térfogaton, amikor a gáz csak felmelegszik.
A folyadékok és a szilárd anyagok melegítéskor kissé kitágulnak. Fajlagos hőkapacitásuk állandó térfogaton és állandó nyomáson alig különbözik.
Fajlagos párolgási hő. Ahhoz, hogy egy folyadékot gőzzé alakítsunk a forrási folyamat során, bizonyos mennyiségű hőt kell átadni rá. A folyadék hőmérséklete nem változik, amikor forr. A folyadék gőzzé alakulása állandó hőmérsékleten nem vezet a molekulák kinetikus energiájának növekedéséhez, hanem kölcsönhatásuk potenciális energiájának növekedésével jár. Végül is a gázmolekulák közötti átlagos távolság sokkal nagyobb, mint a folyadékmolekulák között.
Az 1 kg folyadék állandó hőmérsékletű gőzzé alakításához szükséges hőmennyiséggel számszerűen megegyező értéket ún. fajlagos párolgási hő. Ezt az értéket betű jelöli rés joule per kilogrammban van kifejezve (J/kg).
A víz fajpárolgási hője nagyon magas: rH2O\u003d 2,256 10 6 J / kg 100 °C hőmérsékleten. Más folyadékokban, például alkoholban, éterben, higanyban, kerozinban a párolgási hő 3-10-szer kisebb, mint a vízé.
Folyadékot masszává alakítani m a gőznek annyi hőre van szüksége, mint:
A gőz lecsapódásakor ugyanannyi hő szabadul fel:
Az olvadásponton 1 kg tömegű kristályos anyag folyadékká alakításához szükséges hőmennyiséggel számszerűen megegyező értéket fajlagos olvadási hőnek nevezzük.
Egy 1 kg tömegű anyag kristályosodása során pontosan annyi hő szabadul fel, mint amennyi az olvadáskor elnyelődik.
A jég olvadáshője meglehetősen magas: 3,34 10 5 J/kg. „Ha a jégnek nem lenne nagy olvadási hője” – írta R. Black még a 18. században –, akkor tavasszal a jég teljes tömegének néhány perc vagy másodperc alatt el kellene olvadnia, mivel a hő folyamatosan átadódik a jégnek. a levegőből. Ennek súlyos következményei lennének; mert még a jelenlegi helyzetben is nagy árvizek és nagy vízözönek keletkeznek a nagy jég- vagy hótömegek olvadásából."
Ahhoz, hogy egy kristályos testet tömeggel olvasztson meg m, a szükséges hőmennyiség:
A test kristályosodása során felszabaduló hőmennyiség egyenlő:
A test belső energiája változik felmelegedés és hűtés, párolgás és kondenzáció, olvadás és kristályosodás során. Minden esetben bizonyos mennyiségű hő kerül a szervezetbe, illetve távozik onnan.
???
1. Mit nevezünk mennyiségnek melegség?
2. Mitől függ egy anyag fajlagos hőkapacitása?
3. Mit nevezünk párolgási fajhőnek?
4. Mit nevezünk fajlagos olvadási hőnek?
5. Milyen esetekben pozitív, és milyen esetekben negatív érték a hőmennyiség?
G. Ya. Myakishev, B. B. Buhovcev, N. N. Szockij, fizika 10. osztály
Az óra tartalma óra összefoglalója támogatási keret óra bemutató gyorsító módszerek interaktív technológiák Gyakorlat feladatok és gyakorlatok önvizsgáló műhelyek, tréningek, esetek, küldetések házi feladat megbeszélési kérdések szónoki kérdéseket diákoktól Illusztrációk audio, videoklippek és multimédia fényképek, képek grafika, táblázatok, sémák humor, anekdoták, viccek, képregények példázatok, mondások, keresztrejtvények, idézetek Kiegészítők absztraktokat cikkek chipek érdeklődő csaló lapok tankönyvek alapvető és kiegészítő kifejezések szószedete egyéb Tankönyvek és leckék javításaa tankönyv hibáinak javítása egy töredék frissítése a tankönyvben az innováció elemei a leckében az elavult ismeretek újakkal való helyettesítése Csak tanároknak tökéletes leckék naptári tervet az évre iránymutatásokat vitaprogramok Integrált leckékHa javításai vagy javaslatai vannak ehhez a leckéhez,
Mi melegszik fel gyorsabban a tűzhelyen - egy vízforraló vagy egy vödör víz? A válasz nyilvánvaló - egy vízforraló. Akkor a második kérdés az, hogy miért?
A válasz nem kevésbé nyilvánvaló - mert a vízforralóban kisebb a víz tömege. Kiváló. És most otthon szerezheti meg a legvalódibb fizikai élményt. Ehhez két egyforma kis serpenyőre, azonos mennyiségű vízre és növényi olaj, például fél liter és egy tűzhely. Helyezzen egy edényt olajjal és vízzel ugyanarra a tűzre. És most figyeld, mi fog gyorsabban felmelegedni. Ha van folyadékok hőmérője, akkor használhatja, ha nincs, akkor csak időnként próbálja ki az ujjával a hőmérsékletet, csak vigyázzon, nehogy megégesse magát. Mindenesetre hamarosan látni fogja, hogy az olaj jelentősen felmelegszik. gyorsabb, mint a víz. És még egy kérdés, ami tapasztalat formájában is megvalósítható. Melyik forr gyorsabban - hideg vagy meleg víz? Ismét minden nyilvánvaló – a meleg lesz az első, aki befejezi. Miért ezek a furcsa kérdések és kísérletek? Annak érdekében, hogy meghatározzuk fizikai mennyiség, az úgynevezett "hőmennyiség".
A hőmennyiség
A hőmennyiség az az energia, amelyet a test a hőátadás során elveszít vagy nyer. Ez egyértelmű a névből. Lehűléskor a test bizonyos mennyiségű hőt veszít, felmelegítve pedig elnyeli. A kérdéseinkre adott válaszok pedig megmutatták nekünk mitől függ a hőmennyiség? Először is minél többet testtömeg, annál több hőt kell felhasználni ahhoz, hogy a hőmérséklete egy fokkal megváltozzon. Másodszor, a test felmelegítéséhez szükséges hőmennyiség attól függ, hogy milyen anyagból áll, vagyis az anyag fajtájától. Harmadszor pedig a testhőmérséklet hőátadás előtti és utáni különbsége is fontos számításainkhoz. A fentiek alapján megtehetjük határozza meg a hőmennyiséget a következő képlettel:
Q=cm(t_2-t_1) ,
ahol Q a hőmennyiség,
m - testtömeg,
(t_2-t_1) - különbség a kezdeti és a végső között testhőmérsékletek,
c - az anyag fajlagos hőkapacitása, megtalálható a vonatkozó táblázatokból.
Ezzel a képlettel kiszámíthatja azt a hőmennyiséget, amely bármely test felmelegítéséhez szükséges, vagy amelyet ez a test hűtésekor felszabadít.
A hőmennyiséget joule-ban (1 J) mérik, mint minden más energiafajtát. Ezt az értéket azonban nem olyan régen vezették be, és az emberek sokkal korábban kezdték el mérni a hőmennyiséget. És egy olyan egységet használtak, amelyet korunkban széles körben használnak - egy kalóriát (1 cal). 1 kalória az a hőmennyiség, amely ahhoz szükséges, hogy 1 gramm víz hőmérsékletét 1 Celsius-fokkal megemelje. Ezektől az adatoktól vezérelve az elfogyasztott ételekben lévő kalóriák számolásának szerelmesei az érdeklődés kedvéért ki tudják számítani, hány liter vizet lehet felforralni azzal az energiával, amelyet a nap folyamán étellel fogyasztanak.
 Ha a férj ingerlékeny lett
Ha a férj ingerlékeny lett Tabletták a cukorbetegség számára
Tabletták a cukorbetegség számára Továbbá - kell-e vessző?
Továbbá - kell-e vessző? Hogyan készülnek a számítógépes játékok?
Hogyan készülnek a számítógépes játékok? Álomértelmezés arany, miért álmodik aranyról, álomban aranyról
Álomértelmezés arany, miért álmodik aranyról, álomban aranyról Húgyhólyaghurut húgycsőmosás Hogyan kell felhelyezni a szubklavia katétert
Húgyhólyaghurut húgycsőmosás Hogyan kell felhelyezni a szubklavia katétert Horoszkóp disznó és tigris. Tigris - Malac. Kompatibilitás
Horoszkóp disznó és tigris. Tigris - Malac. Kompatibilitás